Obiective de învățare
- Să coreleze aranjamentul atomilor în tabelul periodic rezultă în blocuri corespunzătoare umplerii orbitalilor ns, np, nd și nf
După cum ați învățat, configurațiile electronice ale elementelor explică forma altfel particulară a tabelului periodic. Deși tabelul a fost organizat inițial pe baza unor asemănări fizice și chimice între elementele din cadrul grupurilor, aceste asemănări se datorează în cele din urmă nivelurilor energetice orbitale și principiului Pauli, care determină umplerea într-o anumită ordine a subînvelișurilor individuale. Ca urmare, tabelul periodic poate fi împărțit în „blocuri” care corespund tipului de subshell care este umplut, așa cum este ilustrat în figura \(\PageIndex{1}\). De exemplu, cele două coloane din stânga, cunoscute sub numele de blocul s, sunt formate din elemente în care sunt ocupați orbitalii ns. Cele șase coloane din dreapta, elemente în care se completează orbitalii np, constituie blocul p. Între ele se află cele 10 coloane ale blocului d, elemente în care sunt ocupați orbitalii (n – 1)d. În partea de jos se află cele 14 coloane ale blocului f, elemente în care sunt completați orbitalii (n – 2)f. Deoarece fiecare orbital poate găzdui câte doi electroni, numărul de coloane din fiecare bloc este egal cu capacitatea maximă de electroni a subshell-ului: 2 pentru ns, 6 pentru np, 10 pentru (n – 1)d și 14 pentru (n – 2)f. În cadrul fiecărei coloane, fiecare element are aceeași configurație electronică de valență – de exemplu, ns1 (grupa 1) sau ns2np1 (grupa 13). După cum veți vedea, acest lucru se reflectă în asemănări importante în ceea ce privește reactivitatea chimică și legăturile pentru elementele din fiecare coloană.
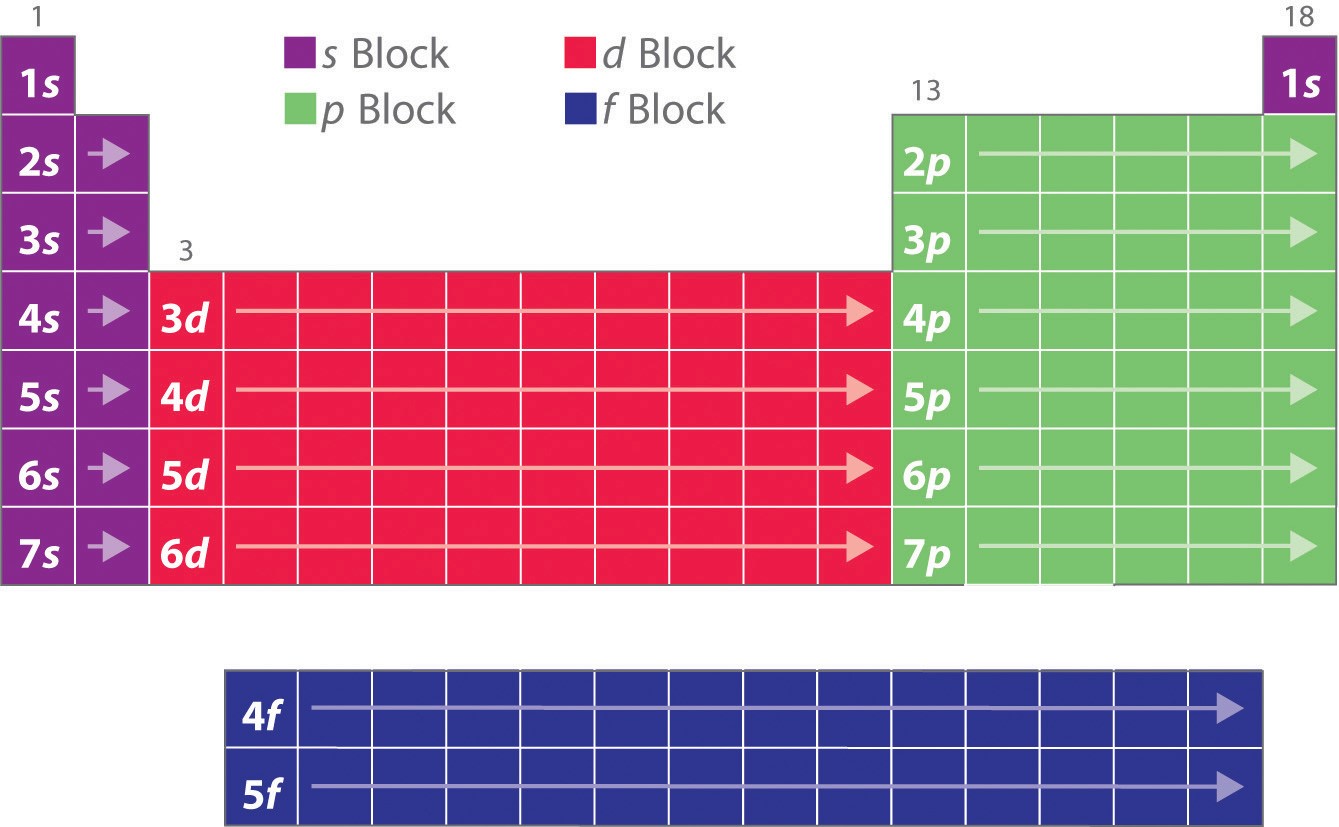
Pentru că fiecare orbital poate avea maximum 2 electroni, există 2 coloane în blocul s, 6 coloane în blocul p, 10 coloane în blocul d și 14 coloane în blocul f.
Hidrogenul și heliul sunt plasate oarecum arbitrar. Deși hidrogenul nu este un metal alcalin, configurația sa electronică 1s1 sugerează o asemănare cu litiul (2s1) și cu celelalte elemente din prima coloană. Deși heliul, cu un subshell ns plin, ar trebui să fie similar din punct de vedere chimic cu alte elemente cu o configurație electronică ns2, învelișul principal închis domină chimia sa, ceea ce justifică plasarea sa deasupra neonului din dreapta.
Exemplu \(\PageIndex{1}\)
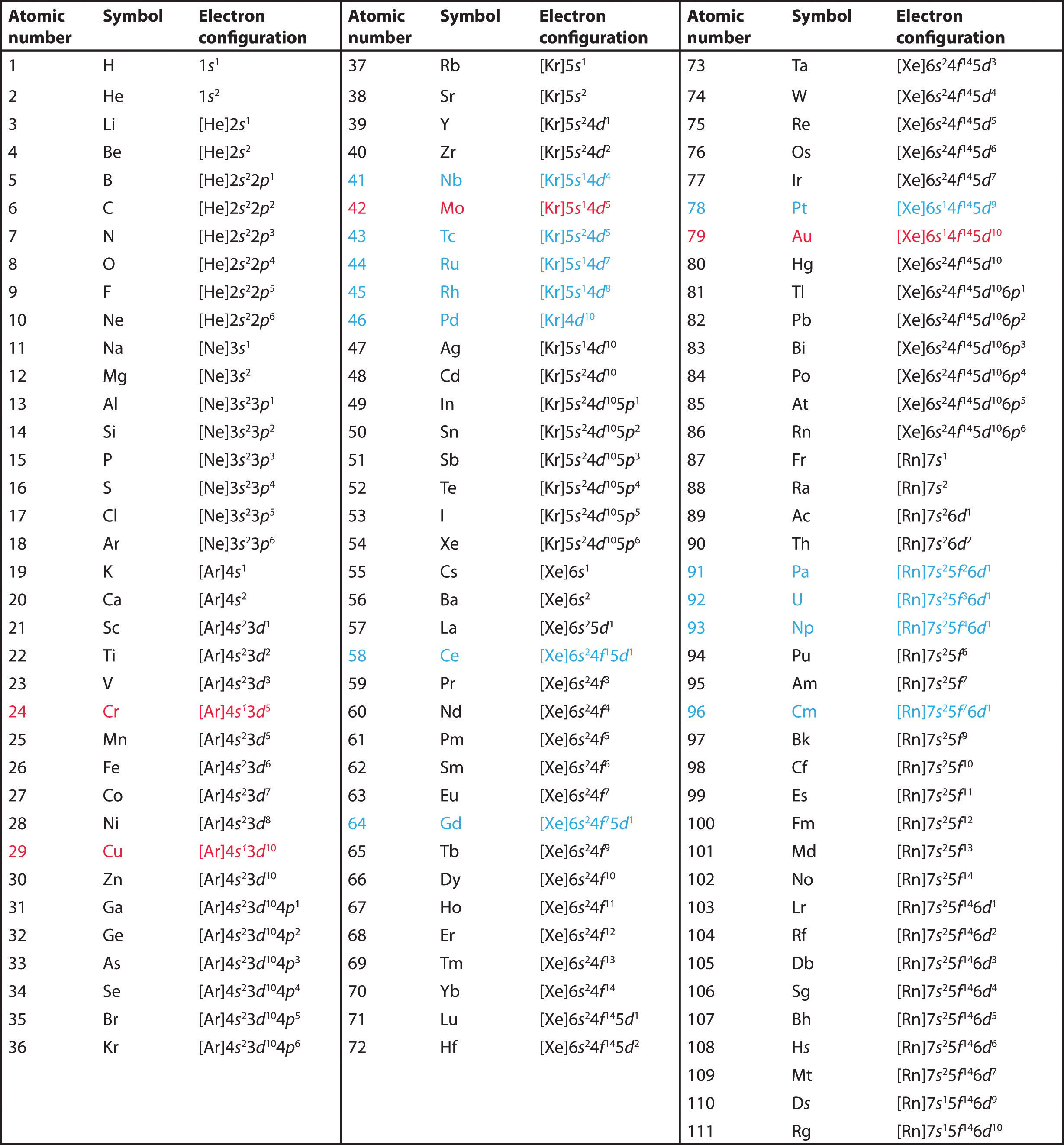
Utilizați tabelul periodic pentru a prezice configurația electronică de valență a tuturor elementelor din grupa 2 (beriliu, magneziu, calciu, stronțiu, bariu și radiu).
Dat: seria de elemente
Se cere: configurațiile electronilor de valență
Strategie:
- Identificați blocul din tabelul periodic din care fac parte elementele din grupa 2. Localizați cel mai apropiat gaz nobil care precede fiecare element și identificați numărul cuantic principal al învelișului de valență al fiecărui element.
- Scrieți configurația electronică de valență a fiecărui element indicând mai întâi învelișurile interioare pline folosind simbolul celui mai apropiat gaz nobil precedent și apoi enumerând numărul cuantic principal al învelișului său de valență, orbitalii săi de valență și numărul de electroni de valență din fiecare orbital ca superscriptori.
Soluție:
A Elementele din grupa 2 se află în blocul s din tabelul periodic și, ca elemente din grupa 2, toate au doi electroni de valență. Începând cu beriliul, vedem că cel mai apropiat gaz nobil precedent este heliul și că numărul cuantic principal al învelișului său de valență este n = 2.
B Astfel, beriliul are o configurație electronică s2. Se așteaptă ca următorul element de jos, magneziul, să aibă exact aceeași dispunere a electronilor în învelișul principal n = 3: s2. Prin extrapolare, ne așteptăm ca toate elementele din grupa 2 să aibă o configurație electronică ns2.
Exercițiu \(\PageIndex{1}\)
Utilizați tabelul periodic pentru a prezice configurația electronică de valență caracteristică a halogenilor din grupa 17.
Răspuns
Toate au o configurație electronică ns2np5, cu un electron mai puțin decât o configurație electronică de gaz nobil. (Rețineți că halogenii mai grei au, de asemenea, subshell-uri (n – 1)d10 umplute, precum și un subshell (n – 2)f14 pentru Rn; acestea nu afectează, totuși, chimia lor în mod semnificativ.
.