Objetivos de aprendizado
- Para correlacionar a disposição dos átomos na tabela periódica resulta em blocos correspondentes ao preenchimento dos ns, np, nd e nf orbitais
Como você aprendeu, as configurações eletrônicas dos elementos explicam a forma peculiar da tabela periódica. Embora a tabela tenha sido originalmente organizada com base nas semelhanças físicas e químicas entre os elementos dentro dos grupos, estas semelhanças são, em última análise, atribuíveis aos níveis de energia orbital e ao princípio de Pauli, que fazem com que as subcasas individuais sejam preenchidas numa ordem particular. Como resultado, a tabela periódica pode ser dividida em “blocos” correspondentes ao tipo de sub-camada que está sendo preenchida, como ilustrado na Figura 1. Por exemplo, as duas colunas da esquerda, conhecidas como bloco s, consistem em elementos nos quais os ns orbitals estão sendo preenchidos. As seis colunas da direita, elementos nos quais os n orbitais estão sendo preenchidos, constituem o bloco p. No meio estão as 10 colunas do bloco d, elementos nos quais os (n – 1)d orbitais estão preenchidos. Na parte inferior estão as 14 colunas do bloco f, elementos nos quais os orbitais (n – 2)f estão preenchidos. Como dois elétrons podem ser acomodados por orbital, o número de colunas em cada bloco é o mesmo que a capacidade máxima de elétrons do subconjunto: 2 para ns, 6 para np, 10 para (n – 1)d, e 14 para (n – 2)f. Dentro de cada coluna, cada elemento tem a mesma configuração eletrônica de valência – por exemplo, ns1 (grupo 1) ou ns2np1 (grupo 13). Como você verá, isto se reflete em semelhanças importantes na reatividade química e na ligação dos elementos em cada coluna.
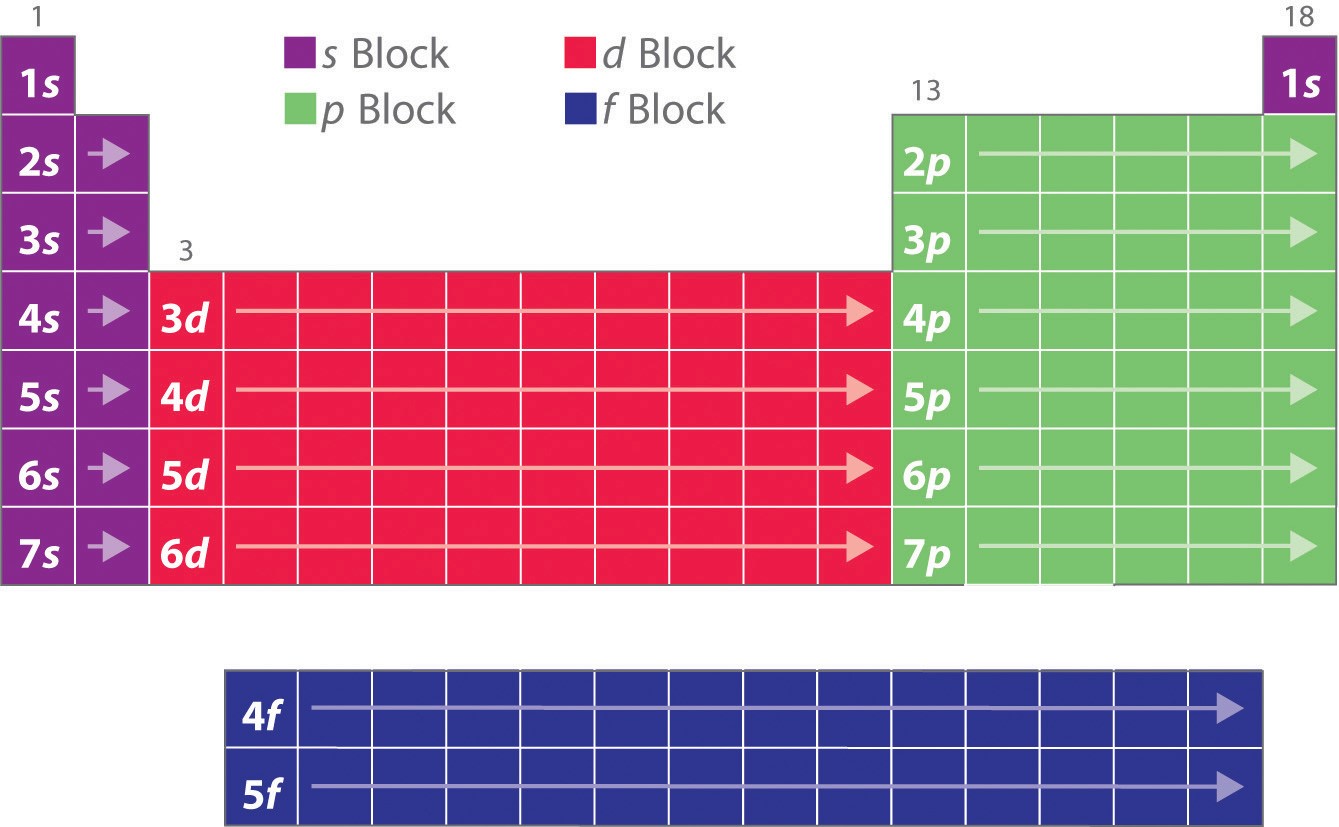
p>Porque cada orbital pode ter no máximo 2 elétrons, há 2 colunas no bloco s, 6 colunas no bloco p, 10 colunas no bloco d e 14 colunas no bloco f.
Hidrogênio e hélio são colocadas de forma um tanto arbitrária. Embora o hidrogénio não seja um metal alcalino, a sua configuração de electrões 1s1 sugere uma semelhança com o lítio (2s1) e os outros elementos da primeira coluna. Embora o hélio, com uma subesfera cheia de ns, deva ser semelhante quimicamente a outros elementos com uma configuração eletrônica de ns2, a casca principal fechada domina sua química, justificando sua colocação acima de neon à direita.
Exemplo \(\PageIndex{1}\)
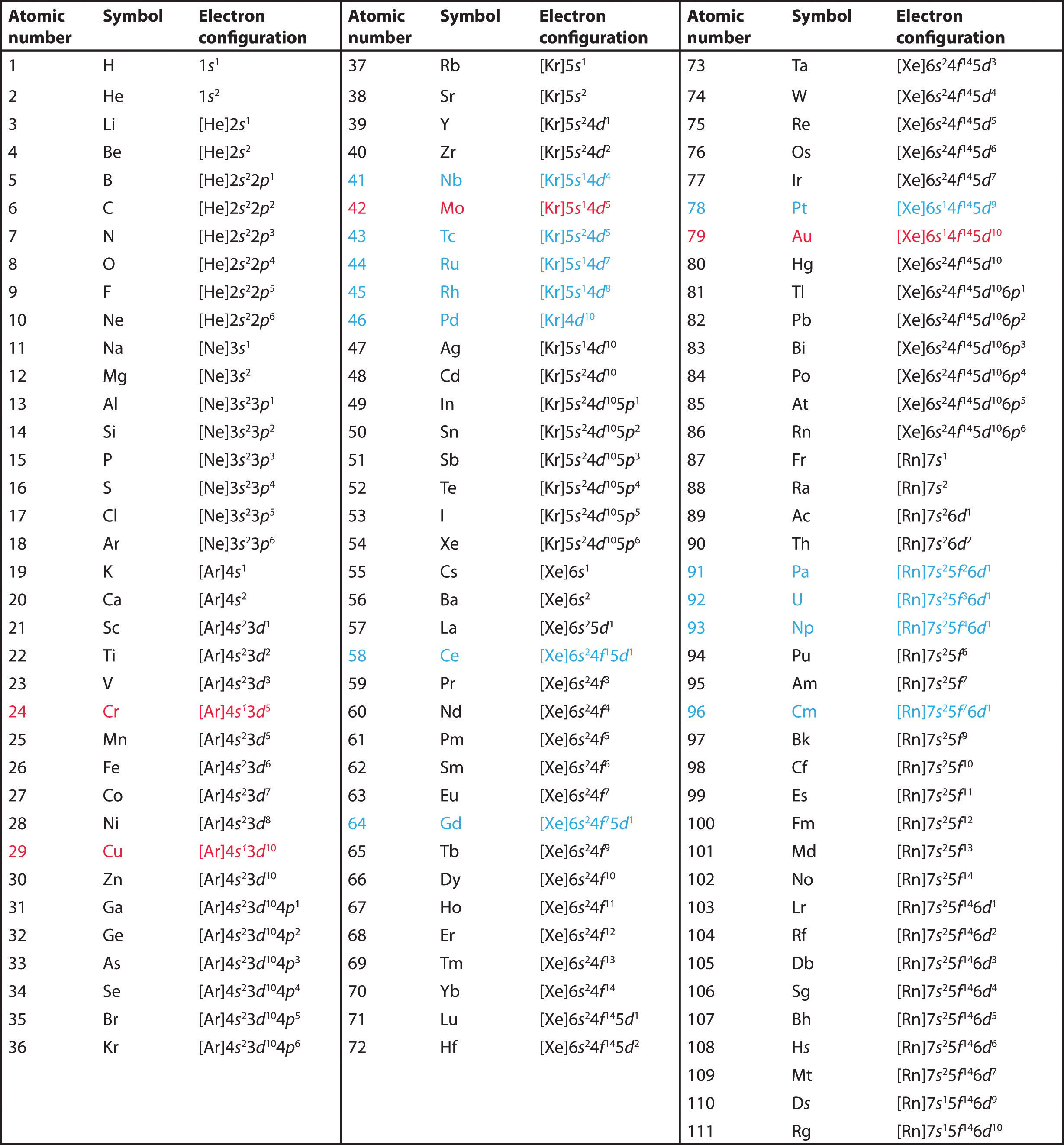
p>Utilizar a tabela periódica para prever a configuração eletrônica de valência de todos os elementos do grupo 2 (berílio, magnésio, cálcio, estrôncio, bário e rádio).
Dado: série de elementos
P>P>Configurações electrónicas de valência
Estratégia:
- Identificar o bloco na tabela periódica a que pertencem os elementos do grupo 2. Localize o gás nobre mais próximo que precede cada elemento e identifique o número quântico principal da casca de valência de cada elemento.
- Escreva a configuração eletrônica de valência de cada elemento indicando primeiro as conchas internas preenchidas usando o símbolo do gás nobre mais próximo e depois listando o número quântico principal da sua casca de valência, seus orbitais de valência e o número de elétrons de valência em cada orbital como superescritos.
Solução:
A Os elementos do grupo 2 estão no bloco s da tabela periódica, e como elementos do grupo 2, todos eles têm dois elétrons de valência. Começando pelo berílio, vemos que o seu gás nobre anterior mais próximo é o hélio e que o número quântico principal da sua concha de valência é n = 2.
B Assim, o berílio tem uma configuração de elétrons s2. O próximo elemento abaixo, o magnésio, deve ter exatamente a mesma disposição de elétrons no n = 3 concha principal: s2. Por extrapolação, esperamos que todos os elementos do grupo 2 tenham uma configuração de elétrons ns2.
Exercicio \(\PageIndex{1}\)
Utilizar a tabela periódica para prever a configuração de elétrons de valência característica dos halógenos do grupo 17.
Resposta
Todos têm uma configuração de elétrons ns2np5, um elétron a menos de uma configuração de elétrons de gás nobre. (Note que os halógenos mais pesados também têm subcasas preenchidas (n – 1)d10, bem como uma subcasa (n – 2)f14 para Rn; estas, no entanto, não afetam sua química de nenhuma forma significativa.