Cele nauczania
- Poprawić układ atomów w układzie okresowym wyniki w blokach odpowiadających wypełnieniu orbitali ns, np, nd, i nf
Jak już się dowiedziałeś, konfiguracje elektronowe pierwiastków wyjaśniają skądinąd osobliwy kształt układu okresowego. Chociaż układ ten był pierwotnie zorganizowany na podstawie fizycznych i chemicznych podobieństw między pierwiastkami w obrębie grup, podobieństwa te można ostatecznie przypisać poziomom energetycznym orbitali i zasadzie Pauliego, które powodują, że poszczególne podpowłoki są wypełnione w określonym porządku. W rezultacie układ okresowy można podzielić na „bloki” odpowiadające rodzajowi wypełnianej podpowłoki, jak pokazano na rysunku. Na przykład, dwie kolumny po lewej stronie, znane jako blok s, składają się z pierwiastków, w których wypełniane są orbitale ns. Sześć kolumn po prawej stronie, elementy, w których wypełniane są orbitale np, stanowią blok p. Pomiędzy nimi znajduje się 10 kolumn bloku d, czyli elementów, w których wypełniane są orbitale (n – 1)d. Na dole znajduje się 14 kolumn bloku f, czyli elementów, w których zapełnione są orbitale (n – 2)f. Ponieważ na jednym orbitalu można zmieścić dwa elektrony, liczba kolumn w każdym bloku jest taka sama jak maksymalna pojemność elektronowa podpowłoki: 2 dla ns, 6 dla np, 10 dla (n – 1)d, i 14 dla (n – 2)f. W obrębie każdej kolumny, każdy element ma taką samą konfigurację elektronów walencyjnych – na przykład ns1 (grupa 1) lub ns2np1 (grupa 13). Jak zobaczysz, jest to odzwierciedlone w ważnych podobieństwach w reaktywności chemicznej i wiązaniu dla pierwiastków w każdej kolumnie.
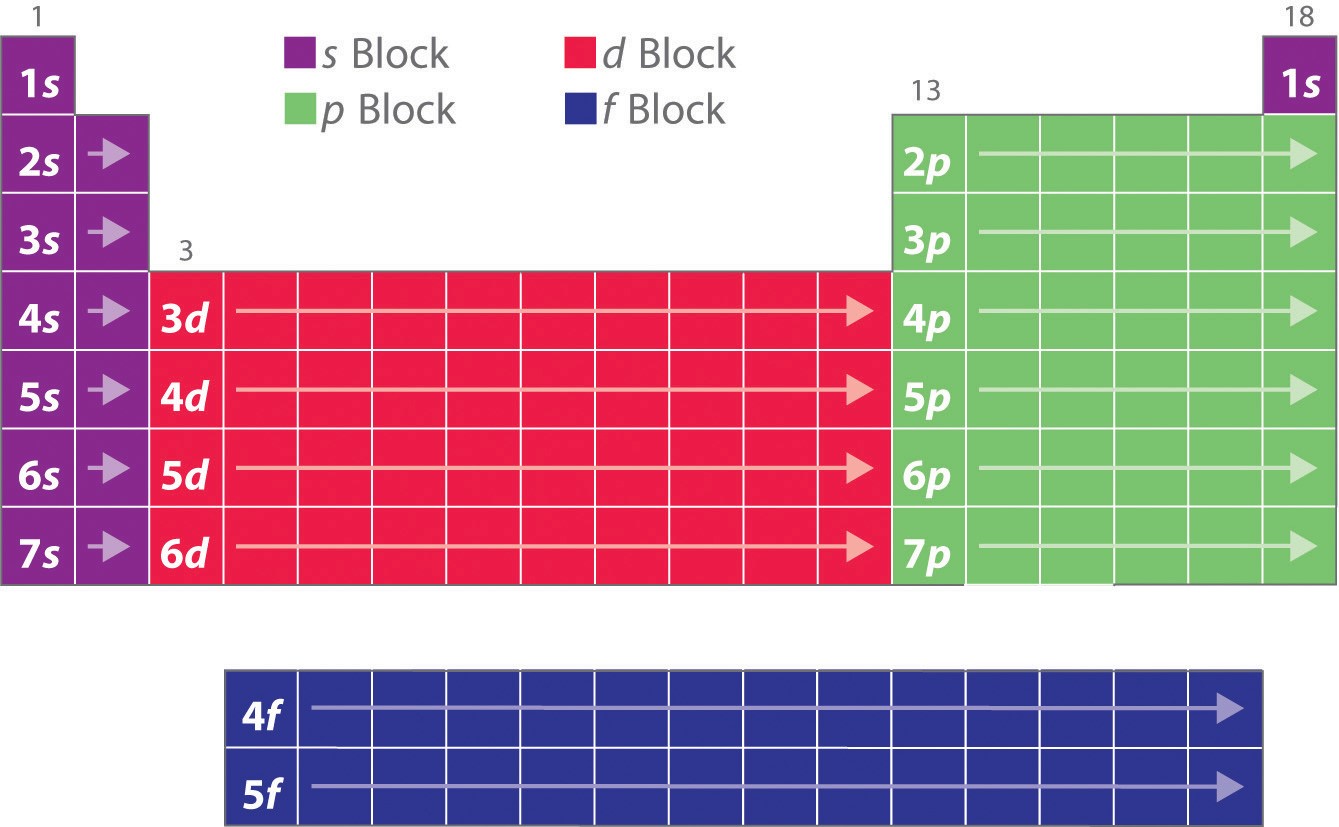
Ponieważ każdy orbital może mieć maksymalnie 2 elektrony, są 2 kolumny w bloku s, 6 kolumn w bloku p, 10 kolumn w bloku d i 14 kolumn w bloku f.
Wodór i hel są umieszczone nieco arbitralnie. Chociaż wodór nie jest metalem alkalicznym, jego konfiguracja elektronowa 1s1 sugeruje podobieństwo do litu (2s1) i innych pierwiastków w pierwszej kolumnie. Chociaż hel, z wypełnioną podpowłoką ns, powinien być podobny chemicznie do innych pierwiastków z konfiguracją elektronową ns2, zamknięta powłoka główna dominuje w jego chemii, uzasadniając umieszczenie go powyżej neonu po prawej stronie.
Przykład
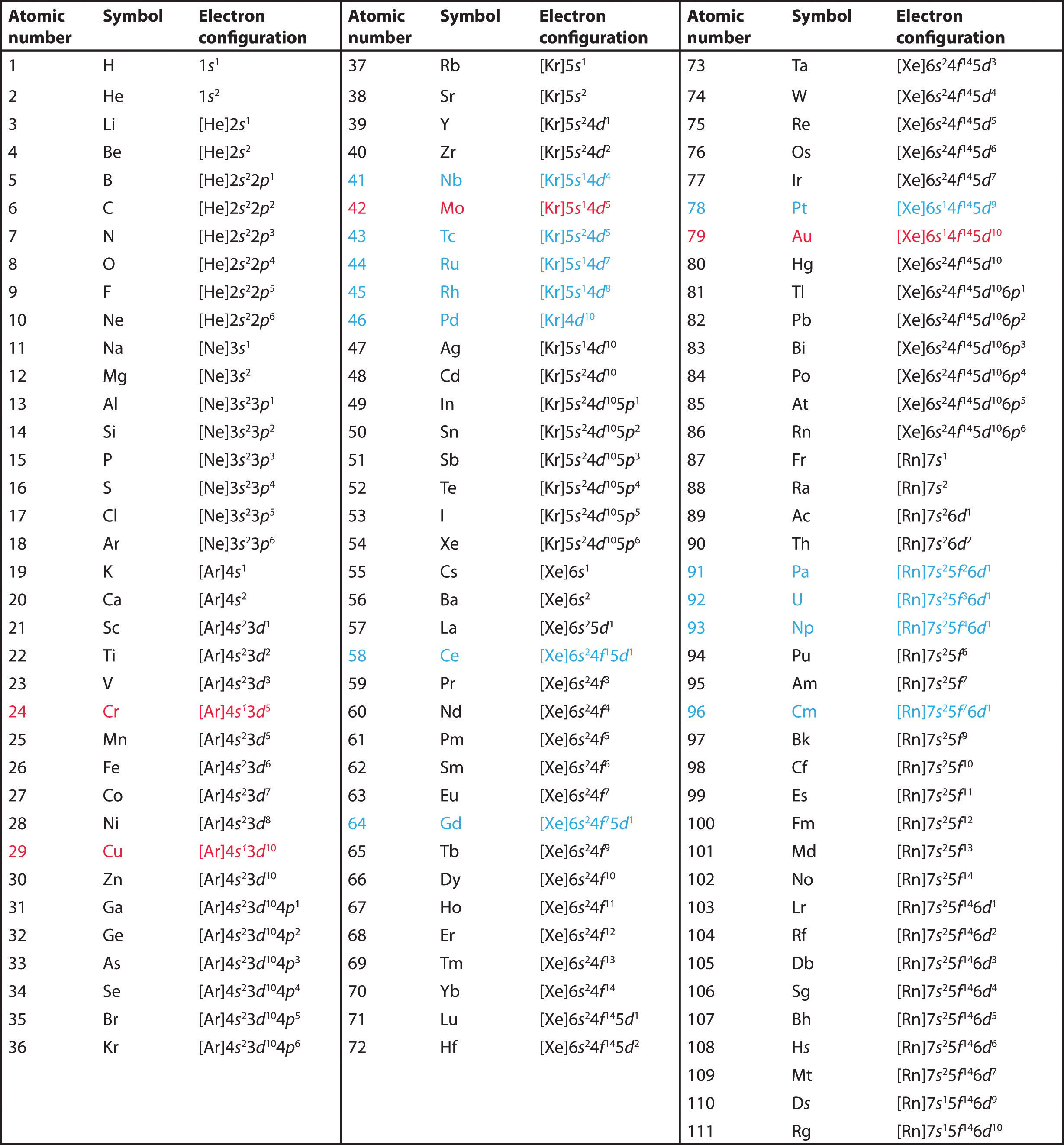
Wykorzystaj układ okresowy do przewidzenia konfiguracji elektronów walencyjnych wszystkich pierwiastków grupy 2 (berylu, magnezu, wapnia, strontu, baru i radu).
Dane: szereg pierwiastków
Pytanie o: konfiguracje elektronów walencyjnych
Strategia:
- Zidentyfikuj blok w układzie okresowym, do którego należą pierwiastki grupy 2. Zlokalizuj najbliższy gaz szlachetny poprzedzający każdy element i zidentyfikuj główną liczbę kwantową powłoki walencyjnej każdego elementu.
- Zapisz konfigurację elektronów walencyjnych każdego elementu, najpierw wskazując wypełnione powłoki wewnętrzne przy użyciu symbolu najbliższego poprzedzającego gazu szlachetnego, a następnie wymieniając główną liczbę kwantową jego powłoki walencyjnej, jego orbitale walencyjne i liczbę elektronów walencyjnych w każdym orbitalu jako indeksy górne.
Rozwiązanie:
A Pierwiastki grupy 2 znajdują się w bloku s układu okresowego, i jako pierwiastki grupy 2, wszystkie mają dwa elektrony walencyjne. Zaczynając od berylu, widzimy, że najbliższym poprzedzającym go gazem szlachetnym jest hel i że główna liczba kwantowa jego powłoki walencyjnej wynosi n = 2.
B Zatem beryl ma konfigurację elektronową s2. Oczekuje się, że następny element w dół, magnez, będzie miał dokładnie taki sam układ elektronów w powłoce głównej n = 3: s2. Przez ekstrapolację oczekujemy, że wszystkie pierwiastki grupy 2 będą miały konfigurację elektronową ns2.
Ćwiczenie
Wykorzystaj układ okresowy, aby przewidzieć charakterystyczną konfigurację elektronów walencyjnych chlorowców w grupie 17.
Odpowiedź
Wszystkie mają konfigurację elektronową ns2np5, jeden elektron brakuje do konfiguracji elektronowej gazu szlachetnego. (Zauważ, że cięższe chlorowce mają również wypełnione (n – 1)d10 podpowłoki, jak również (n – 2)f14 podpowłoki dla Rn; to jednak nie wpływa na ich chemię w żaden znaczący sposób.