Objetivos de aprendizaje
- Correlacionar la disposición de los átomos en los resultados de la tabla periódica en bloques correspondientes al llenado de los orbitales ns, np, nd y nf
Como has aprendido, las configuraciones electrónicas de los elementos explican la forma, por otra parte peculiar, de la tabla periódica. Aunque la tabla se organizó originalmente sobre la base de las similitudes físicas y químicas entre los elementos dentro de los grupos, estas similitudes son, en última instancia, atribuibles a los niveles de energía orbital y al principio de Pauli, que hacen que las subcubiertas individuales se llenen en un orden particular. Como resultado, la tabla periódica se puede dividir en «bloques» que corresponden al tipo de subcáscara que se llena, como se ilustra en la Figura \ (\PageIndex{1}). Por ejemplo, las dos columnas de la izquierda, conocidas como el bloque s, consisten en elementos en los que se llenan los orbitales ns. Las seis columnas de la derecha, elementos en los que se llenan los orbitales np, constituyen el bloque p. En medio están las 10 columnas del bloque d, elementos en los que se llenan los orbitales (n – 1)d. En la parte inferior se encuentran las 14 columnas del bloque f, elementos en los que se llenan los orbitales (n – 2)f. Dado que se pueden acomodar dos electrones por orbital, el número de columnas de cada bloque es el mismo que la capacidad máxima de electrones del subfondo: 2 para ns, 6 para np, 10 para (n – 1)d y 14 para (n – 2)f. Dentro de cada columna, cada elemento tiene la misma configuración de electrones de valencia, por ejemplo, ns1 (grupo 1) o ns2np1 (grupo 13). Como verás, esto se refleja en importantes similitudes en la reactividad química y en el enlace de los elementos de cada columna.
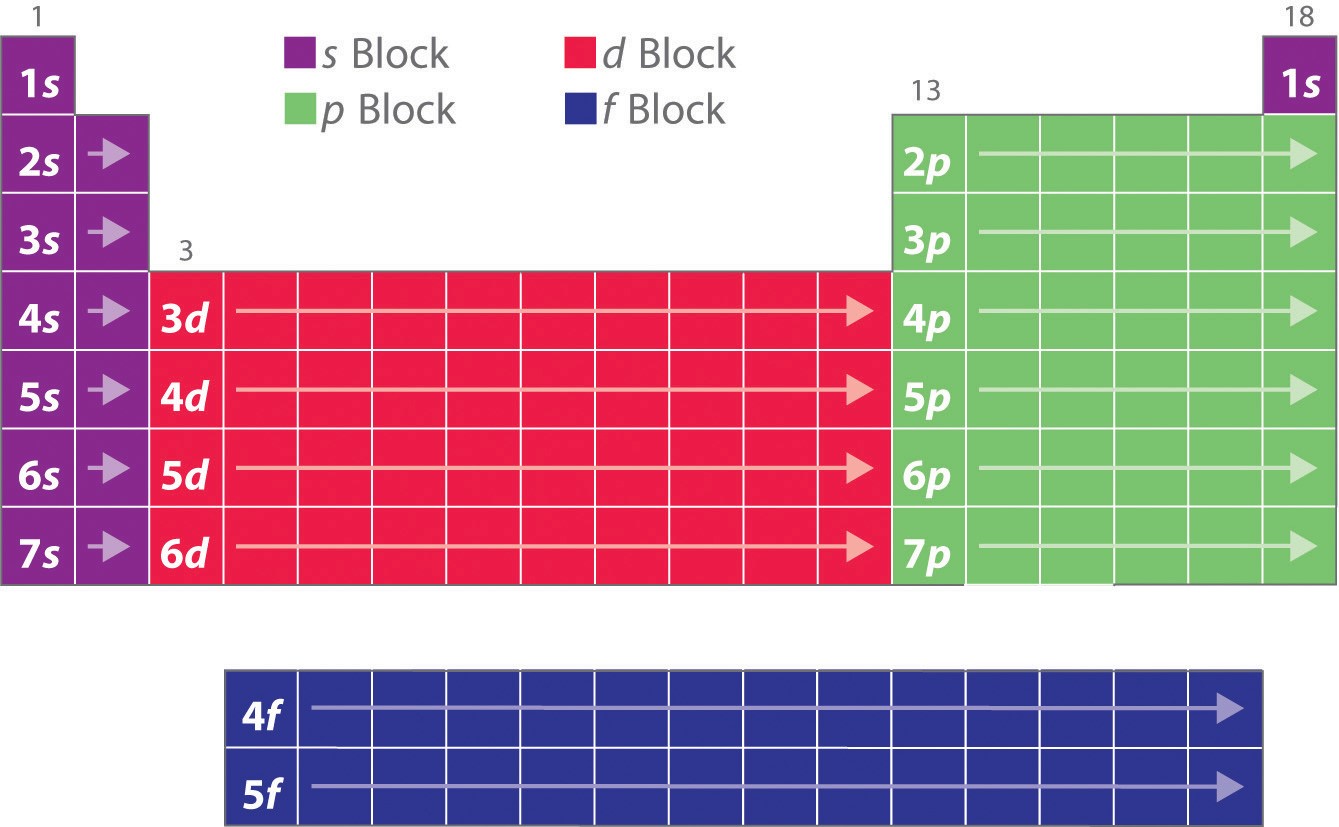
Debido a que cada orbital puede tener un máximo de 2 electrones, hay 2 columnas en el bloque s, 6 columnas en el bloque p, 10 columnas en el bloque d y 14 columnas en el bloque f.
El hidrógeno y el helio están colocados de forma un tanto arbitraria. Aunque el hidrógeno no es un metal alcalino, su configuración electrónica 1s1 sugiere una similitud con el litio (2s1) y los otros elementos de la primera columna. Aunque el helio, con una subcáscara ns llena, debería ser similar químicamente a otros elementos con una configuración de electrones ns2, la cáscara principal cerrada domina su química, justificando su colocación por encima del neón a la derecha.
Ejemplo (\PageIndex{1})
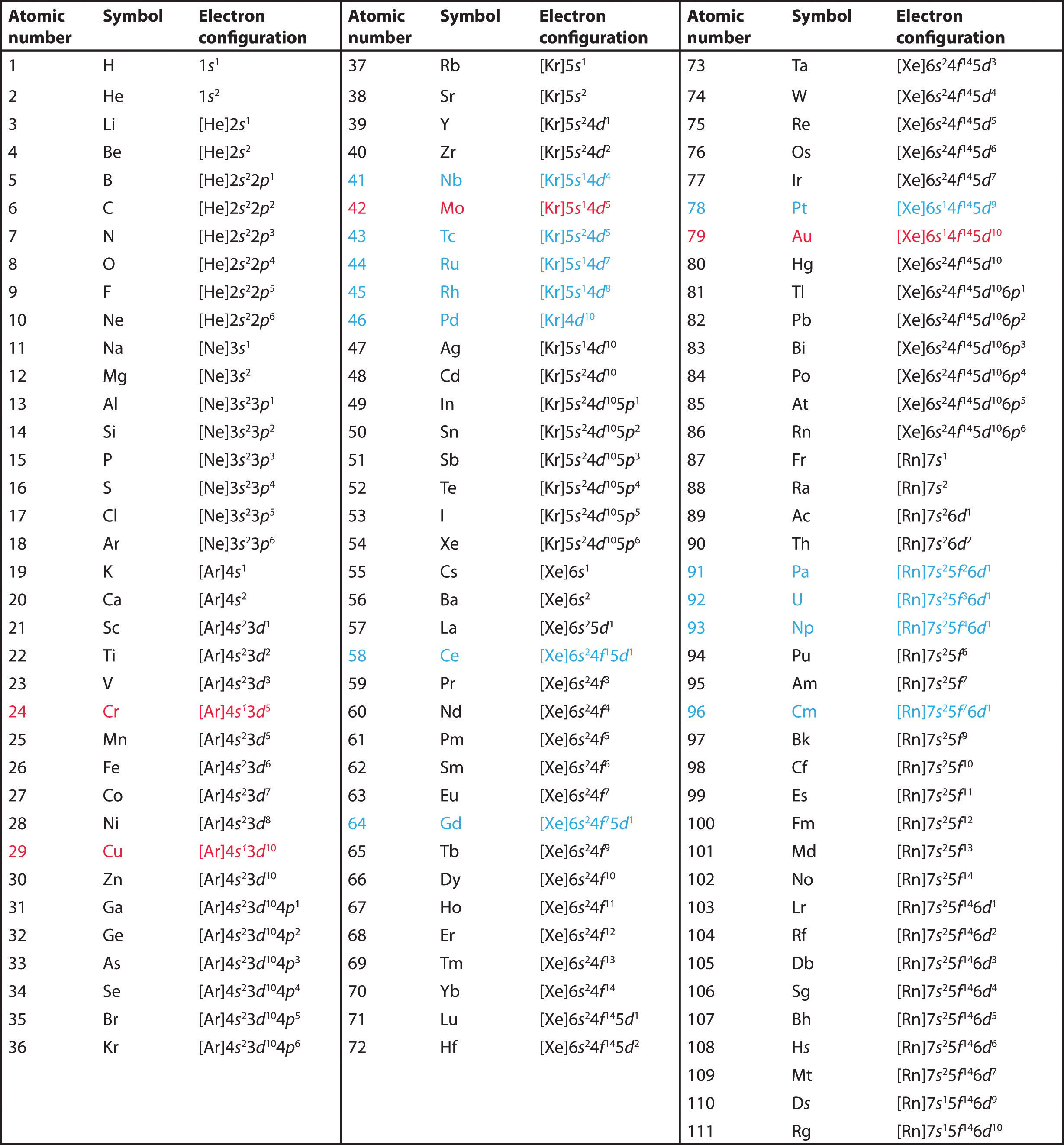
Utiliza la tabla periódica para predecir la configuración electrónica de valencia de todos los elementos del grupo 2 (berilio, magnesio, calcio, estroncio, bario y radio).
Dado: serie de elementos
Se pide: configuraciones de electrones de valencia
Estrategia:
- Identificar el bloque de la tabla periódica al que pertenecen los elementos del grupo 2. Localice el gas noble más cercano que precede a cada elemento e identifique el número cuántico principal de la capa de valencia de cada elemento.
- Escriba la configuración de electrones de valencia de cada elemento indicando primero las capas internas llenas utilizando el símbolo del gas noble precedente más cercano y enumerando después el número cuántico principal de su capa de valencia, sus orbitales de valencia y el número de electrones de valencia en cada orbital como superíndices.
Solución:
A Los elementos del grupo 2 están en el bloque s de la tabla periódica, y como elementos del grupo 2, todos tienen dos electrones de valencia. Empezando por el berilio, vemos que su gas noble precedente más cercano es el helio y que el número cuántico principal de su capa de valencia es n = 2.
B Así, el berilio tiene una configuración electrónica s2. Se espera que el siguiente elemento hacia abajo, el magnesio, tenga exactamente la misma disposición de electrones en la capa principal n = 3: s2. Por extrapolación, esperamos que todos los elementos del grupo 2 tengan una configuración electrónica ns2.
Ejercicio (\PageIndex{1})
Utiliza la tabla periódica para predecir la configuración electrónica de valencia característica de los halógenos del grupo 17.
Todos tienen una configuración electrónica ns2np5, un electrón menos que la configuración electrónica de un gas noble. (Tenga en cuenta que los halógenos más pesados también tienen subesferas (n – 1)d10 llenas, así como una subesfera (n – 2)f14 para Rn; sin embargo, esto no afecta a su química de manera significativa.