Objectifs d’apprentissage
- Corréler l’arrangement des atomes dans les résultats du tableau périodique en blocs correspondant au remplissage des orbitales ns, np, nd et nf
Comme vous l’avez appris, les configurations électroniques des éléments expliquent la forme autrement particulière du tableau périodique. Bien que le tableau ait été organisé à l’origine sur la base de similitudes physiques et chimiques entre les éléments au sein des groupes, ces similitudes sont finalement attribuables aux niveaux d’énergie orbitale et au principe de Pauli, qui font que les sous-coquilles individuelles sont remplies dans un ordre particulier. Par conséquent, le tableau périodique peut être divisé en « blocs » correspondant au type de sous-coquille qui est rempli, comme l’illustre la figure \(\PageIndex{1}\). Par exemple, les deux colonnes de gauche, appelées bloc s, sont constituées d’éléments dans lesquels les orbitales ns sont remplies. Les six colonnes de droite, éléments dans lesquels les orbitales np sont remplies, constituent le bloc p. Entre les deux se trouvent les 10 colonnes du bloc d, éléments dans lesquels les orbitales (n – 1)d sont remplies. En bas, on trouve les 14 colonnes du bloc f, éléments dans lesquels les (n – 2)f orbitales sont remplies. Étant donné que chaque orbitale peut accueillir deux électrons, le nombre de colonnes dans chaque bloc est égal à la capacité électronique maximale de la sous-couche : 2 pour ns, 6 pour np, 10 pour (n – 1)d et 14 pour (n – 2)f. Dans chaque colonne, chaque élément a la même configuration électronique de valence, par exemple, ns1 (groupe 1) ou ns2np1 (groupe 13). Comme vous le verrez, cela se traduit par d’importantes similitudes dans la réactivité chimique et la liaison des éléments de chaque colonne.
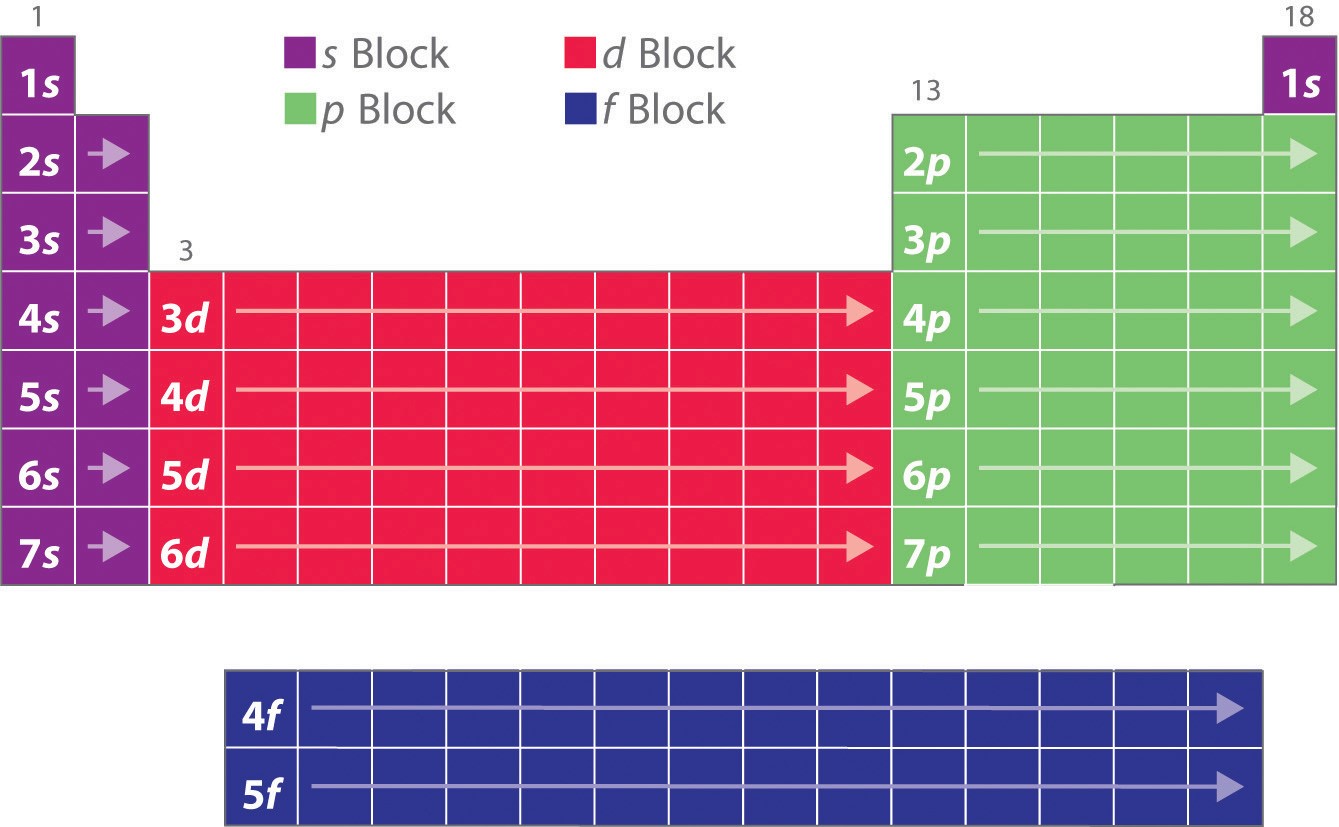
Parce que chaque orbitale peut avoir un maximum de 2 électrons, il y a 2 colonnes dans le bloc s, 6 colonnes dans le bloc p, 10 colonnes dans le bloc d et 14 colonnes dans le bloc f.
L’hydrogène et l’hélium sont placés de façon quelque peu arbitraire. Bien que l’hydrogène ne soit pas un métal alcalin, sa configuration électronique 1s1 suggère une similitude avec le lithium (2s1) et les autres éléments de la première colonne. Bien que l’hélium, avec une sous-coquille ns remplie, devrait être chimiquement similaire aux autres éléments ayant une configuration électronique ns2, la coquille principale fermée domine sa chimie, ce qui justifie son placement au-dessus du néon sur la droite.
Exemple \(\PageIndex{1}\)
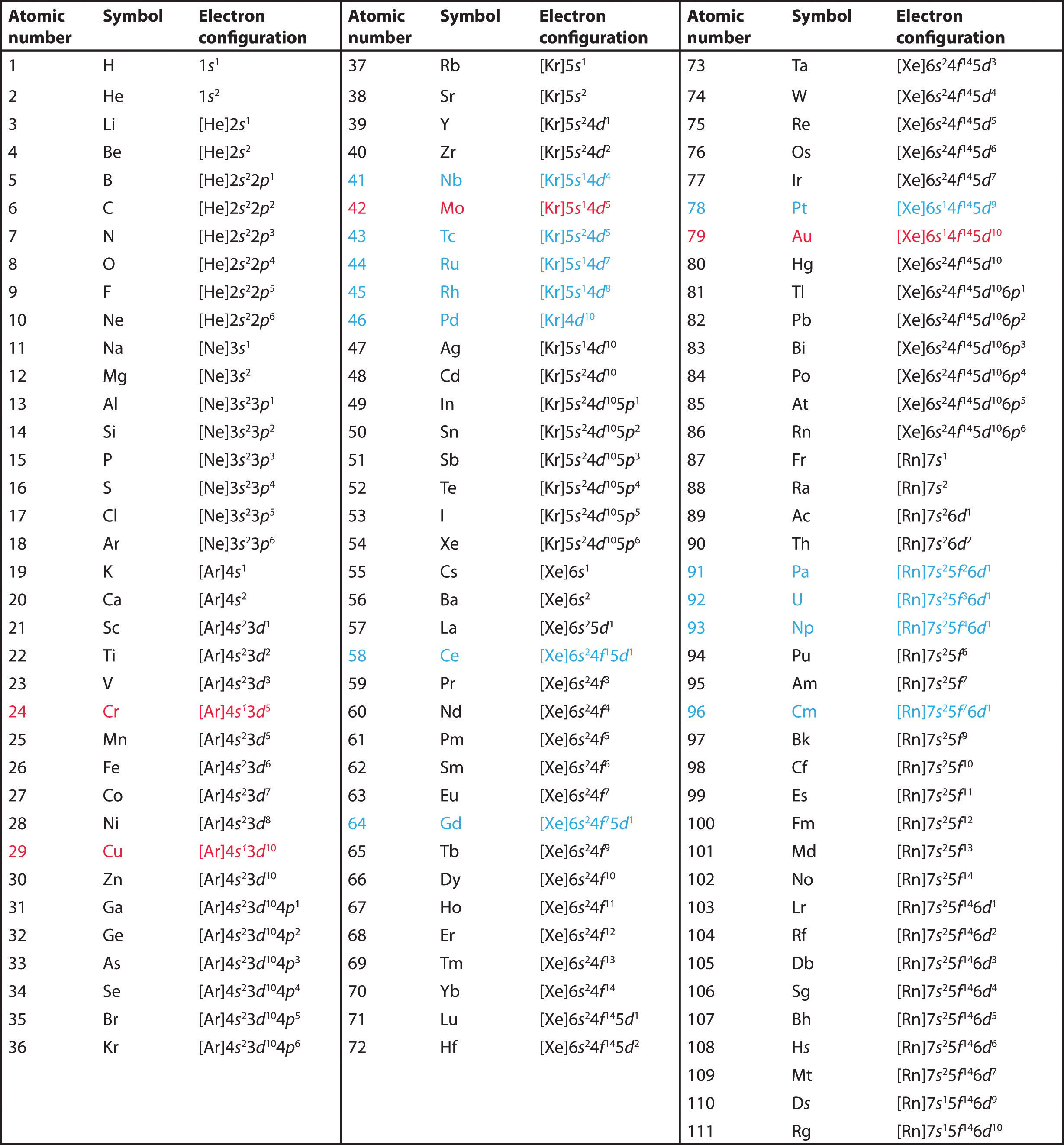
Utilisez le tableau périodique pour prédire la configuration des électrons de valence de tous les éléments du groupe 2 (béryllium, magnésium, calcium, strontium, baryum et radium).
Donné : série d’éléments
Demandé : configurations des électrons de valence
Stratégie :
- Identifiez le bloc du tableau périodique auquel appartiennent les éléments du groupe 2. Localisez le gaz rare le plus proche précédant chaque élément et identifiez le nombre quantique principal de la coquille de valence de chaque élément.
- Écrivez la configuration des électrons de valence de chaque élément en indiquant d’abord les coquilles internes remplies à l’aide du symbole du gaz rare précédent le plus proche, puis en énumérant le nombre quantique principal de sa coquille de valence, ses orbitales de valence et le nombre d’électrons de valence dans chaque orbitale en exposant.
Solution:
A Les éléments du groupe 2 sont dans le bloc s du tableau périodique, et en tant qu’éléments du groupe 2, ils ont tous deux électrons de valence. En commençant par le béryllium, nous voyons que son gaz noble précédent le plus proche est l’hélium et que le nombre quantique principal de sa coquille de valence est n = 2.
B Ainsi, le béryllium a une configuration électronique s2. L’élément suivant vers le bas, le magnésium, devrait avoir exactement la même disposition des électrons dans la coquille principale n = 3 : s2. Par extrapolation, on s’attend à ce que tous les éléments du groupe 2 aient une configuration électronique ns2.
Exercice \(\PageIndex{1}\)
Utiliser le tableau périodique pour prédire la configuration électronique de valence caractéristique des halogènes du groupe 17.
Réponse
Tous ont une configuration électronique ns2np5, un électron de moins qu’une configuration électronique de gaz noble. (Notez que les halogènes les plus lourds ont également des sous-coquilles (n – 1)d10 remplies, ainsi qu’une sous-coquille (n – 2)f14 pour Rn ; celles-ci n’affectent cependant pas leur chimie de manière significative.