Obiettivi di apprendimento
- Correggere la disposizione degli atomi nella tavola periodica in blocchi corrispondenti al riempimento degli orbitali ns, np, nd e nf
Come hai imparato, le configurazioni elettroniche degli elementi spiegano la forma altrimenti particolare della tavola periodica. Sebbene la tavola sia stata originariamente organizzata sulla base di somiglianze fisiche e chimiche tra gli elementi all’interno dei gruppi, queste somiglianze sono in definitiva attribuibili ai livelli di energia orbitale e al principio di Pauli, che fanno sì che i singoli sottogusci siano riempiti in un ordine particolare. Di conseguenza, la tavola periodica può essere divisa in “blocchi” corrispondenti al tipo di sottoguscio che viene riempito, come illustrato nella figura \(\PageIndex{1}). Per esempio, le due colonne a sinistra, conosciute come il blocco s, consistono di elementi in cui gli orbitali ns vengono riempiti. Le sei colonne a destra, elementi in cui vengono riempiti gli orbitali np, costituiscono il blocco p. In mezzo ci sono le 10 colonne del blocco d, elementi in cui vengono riempiti gli orbitali (n – 1)d. In basso si trovano le 14 colonne del blocco f, elementi in cui vengono riempiti gli orbitali (n – 2)f. Poiché possono essere ospitati due elettroni per orbitale, il numero di colonne in ogni blocco è uguale alla capacità massima di elettroni del sottoguscio: 2 per ns, 6 per np, 10 per (n – 1)d, e 14 per (n – 2)f. All’interno di ogni colonna, ogni elemento ha la stessa configurazione elettronica di valenza, per esempio, ns1 (gruppo 1) o ns2np1 (gruppo 13). Come vedrai, questo si riflette in importanti somiglianze nella reattività chimica e nel legame per gli elementi di ogni colonna.
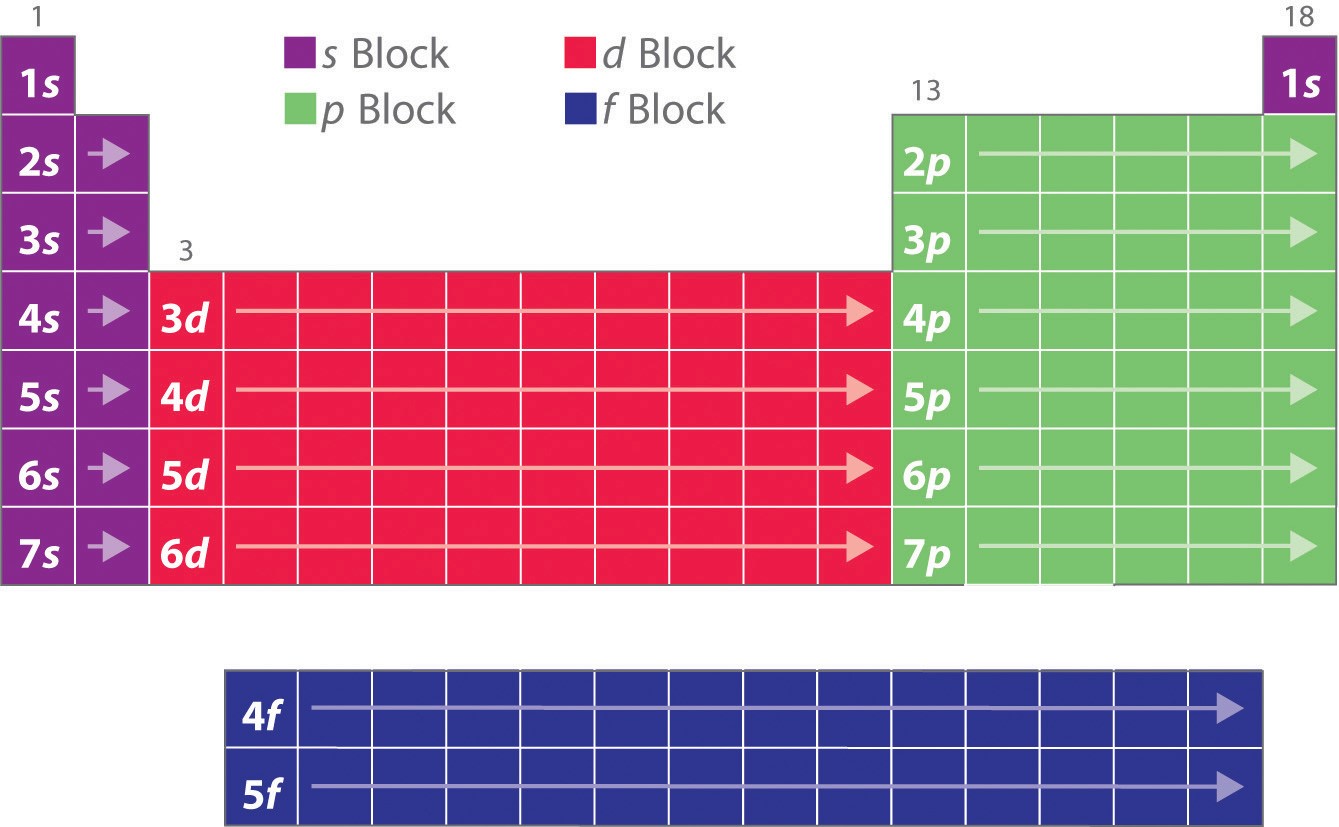
Perché ogni orbitale può avere un massimo di 2 elettroni, ci sono 2 colonne nel blocco s, 6 colonne nel blocco p, 10 colonne nel blocco d, e 14 colonne nel blocco f.
L’idrogeno e l’elio sono collocati in modo piuttosto arbitrario. Anche se l’idrogeno non è un metallo alcalino, la sua configurazione elettronica 1s1 suggerisce una somiglianza con il litio (2s1) e gli altri elementi della prima colonna. Anche se l’elio, con un sottoguscio ns riempito, dovrebbe essere chimicamente simile ad altri elementi con una configurazione elettronica ns2, il guscio principale chiuso domina la sua chimica, giustificando il suo posizionamento sopra il neon sulla destra.
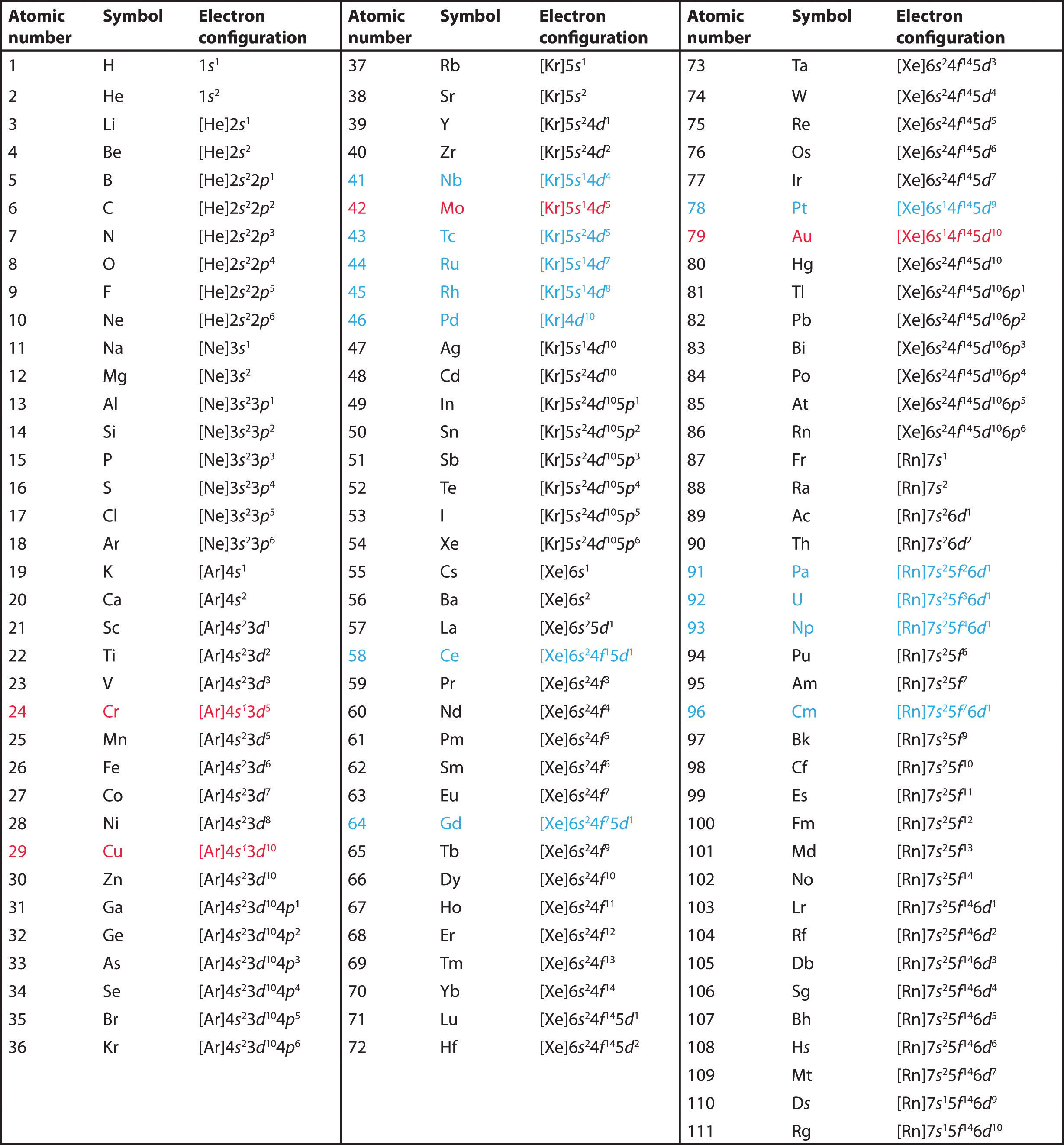
Esempio \(\PageIndex{1})
Usa la tavola periodica per prevedere la configurazione degli elettroni di valenza di tutti gli elementi del gruppo 2 (berillio, magnesio, calcio, stronzio, bario e radio).
Dato: serie di elementi
Chiesto: configurazioni degli elettroni di valenza
Strategia:
- Identifica il blocco della tavola periodica a cui appartengono gli elementi del gruppo 2. Individua il gas nobile più vicino che precede ogni elemento e identifica il numero quantico principale del guscio di valenza di ogni elemento.
- Scrivi la configurazione degli elettroni di valenza di ogni elemento indicando prima i gusci interni pieni usando il simbolo del gas nobile più vicino che lo precede e poi elencando il numero quantico principale del suo guscio di valenza, i suoi orbitali di valenza e il numero di elettroni di valenza in ogni orbitale in apice.
Soluzione:
A Gli elementi del gruppo 2 sono nel blocco s della tavola periodica, e come elementi del gruppo 2, hanno tutti due elettroni di valenza. Iniziando con il berillio, vediamo che il suo gas nobile precedente più vicino è l’elio e che il numero quantico principale del suo guscio di valenza è n = 2.
B Così il berillio ha una configurazione elettronica s2. L’elemento successivo, il magnesio, dovrebbe avere esattamente la stessa disposizione degli elettroni nel guscio principale n = 3: s2. Per estrapolazione, ci aspettiamo che tutti gli elementi del gruppo 2 abbiano una configurazione elettronica ns2.
Esercizio \(\PageIndex{1})
Usa la tavola periodica per predire la configurazione elettronica di valenza caratteristica degli alogeni del gruppo 17.
Risposta
Tutti hanno una configurazione elettronica ns2np5, un elettrone in meno di una configurazione elettronica da gas nobile. (Si noti che gli alogeni più pesanti hanno anche sottogusci riempiti (n – 1)d10, così come un sottoguscio (n – 2)f14 per Rn; questi, tuttavia, non influenzano la loro chimica in modo significativo.