Lärandemål
- Att korrelera atomernas arrangemang i det periodiska systemet resulterar i block som motsvarar fyllning av ns, np, nd och nf-orbitalerna
Som du har lärt dig förklarar grundämnenas elektronkonfigurationer den i övrigt säregna formen på det periodiska systemet. Även om systemet ursprungligen organiserades på grundval av fysiska och kemiska likheter mellan grundämnena inom grupperna, kan dessa likheter i slutändan tillskrivas orbitala energinivåer och Pauliprincipen, som gör att de enskilda underskalorna fylls i en viss ordning. Som ett resultat av detta kan det periodiska systemet delas in i ”block” som motsvarar den typ av underskal som fylls, vilket illustreras i figur \(\PageIndex{1}\). Till exempel består de två kolumnerna till vänster, det så kallade s-blocket, av grundämnen där ns-orbitalerna fylls. De sex kolumnerna till höger, element där np-orbitalerna fylls, utgör p-blocket. Däremellan finns de tio kolumnerna i d-blocket, element där (n – 1)d-orbitalerna fylls. Längst ner ligger de 14 kolumnerna i f-blocket, element i vilka (n – 2)f-orbitalerna fylls. Eftersom två elektroner kan rymmas i varje orbital är antalet kolumner i varje block detsamma som den maximala elektronkapaciteten i underskalet: 2 för ns, 6 för np, 10 för (n – 1)d och 14 för (n – 2)f. Inom varje kolumn har varje element samma valenselektronkonfiguration – till exempel ns1 (grupp 1) eller ns2np1 (grupp 13). Som du kommer att se återspeglas detta i viktiga likheter i den kemiska reaktiviteten och bindningarna för grundämnena i varje kolumn.
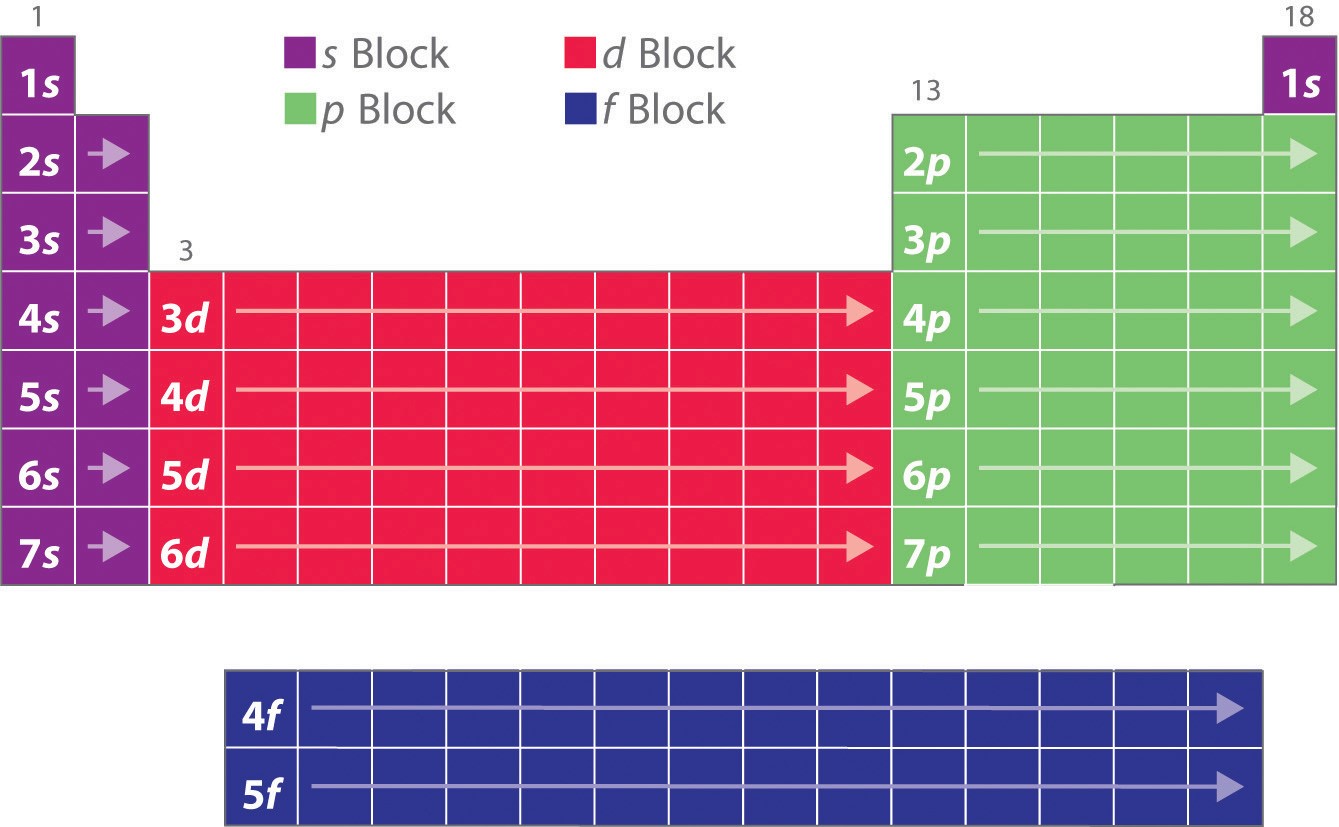
Eftersom varje orbital kan ha högst 2 elektroner finns det 2 kolumner i s-blocket, 6 kolumner i p-blocket, 10 kolumner i d-blocket och 14 kolumner i f-blocket.
Vätgas och helium är placerade något godtyckligt. Även om väte inte är en alkalimetall tyder dess elektronkonfiguration 1s1 på en likhet med litium (2s1) och de andra grundämnena i den första kolumnen. Även om helium, med ett fyllt ns-subskal, borde kemiskt likna andra grundämnen med en ns2-elektronkonfiguration, dominerar det slutna huvudskalet dess kemi, vilket motiverar dess placering ovanför neon till höger.
Exempel \(\PageIndex{1}\)
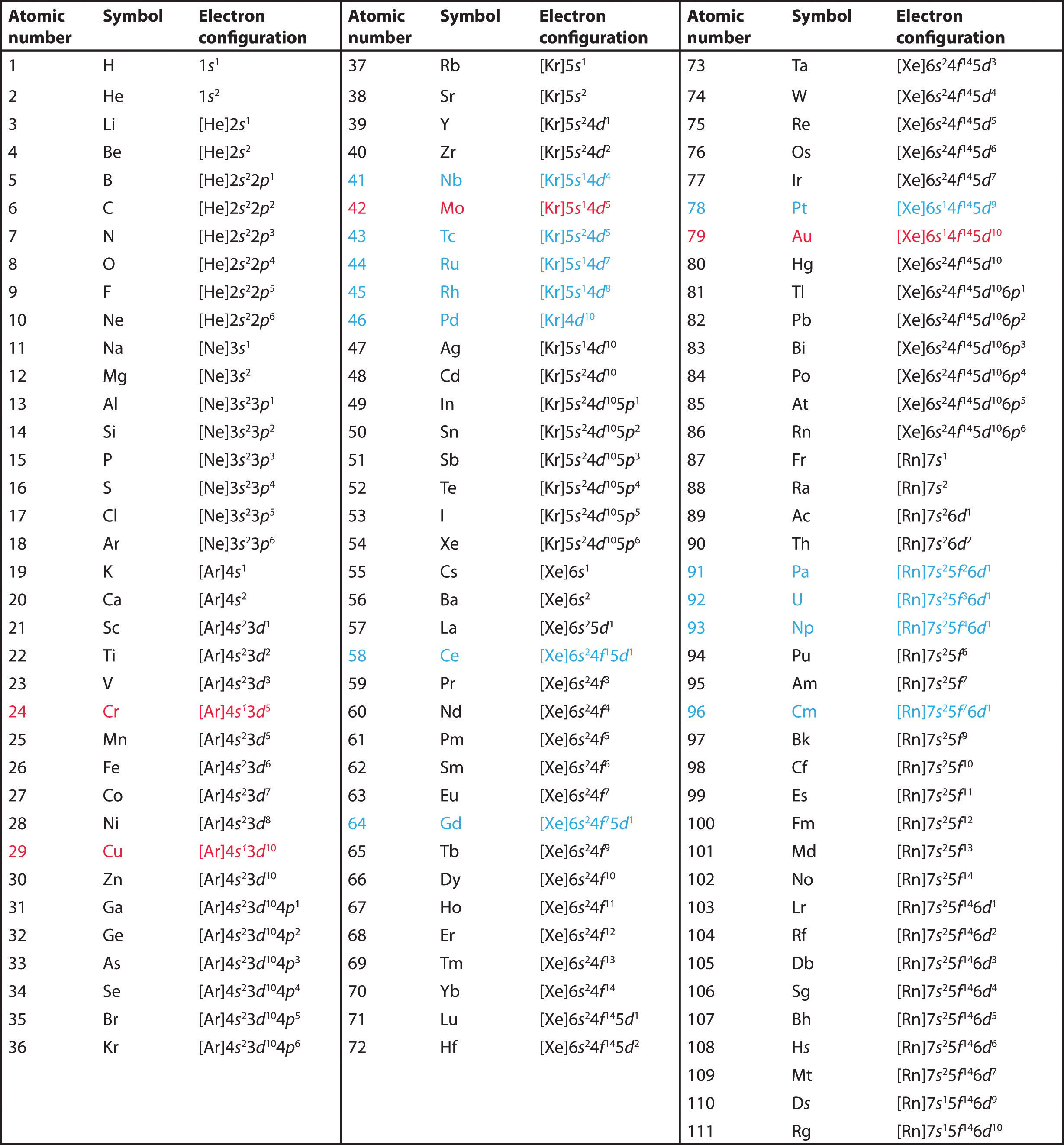
Använd det periodiska systemet för att förutsäga valenselektronkonfigurationen för alla grundämnen i grupp 2 (beryllium, magnesium, kalcium, strontium, barium och radium).
Givet: serie av grundämnen
Sökt: valenselektronkonfigurationer
Strategi:
- Identifiera det block i det periodiska systemet som grundämnena i grupp 2 tillhör. Leta upp den närmaste ädelgasen som föregår varje grundämne och identifiera huvudkvantnumret för varje grundämnes valensskal.
- Skriv valenceelektronkonfigurationen för varje grundämne genom att först ange de fyllda inre skalen med hjälp av symbolen för den närmaste ädelgasen som föregår och sedan ange huvudkvantnumret för dess valensskal, dess valensorbitaler och antalet valenceelektroner i varje orbital som överordnad beteckning.
Lösning:
A Grundämnena i grupp 2 finns i s-blocket i det periodiska systemet, och som grundämnen i grupp 2 har de alla två valenceelektroner. Om vi börjar med beryllium ser vi att dess närmast föregående ädelgas är helium och att det huvudsakliga kvantantalet i dess valensskal är n = 2.
B Beryllium har alltså en s2-elektronkonfiguration. Det nästföljande grundämnet, magnesium, förväntas ha exakt samma arrangemang av elektroner i huvudskalet n = 3: s2. Genom extrapolering förväntar vi oss att alla grundämnen i grupp 2 har en ns2-elektronkonfiguration.
Övningsuppgift \(\PageIndex{1}\)
Använd det periodiska systemet för att förutsäga den karakteristiska valenselektronkonfigurationen för halogenerna i grupp 17.
Svar
Alla har en ns2np5-elektronkonfiguration, en elektron för kort för att uppnå en elektronkonfiguration för en ädelgas. (Observera att de tyngre halogenerna också har fyllda (n – 1)d10-underskal, samt ett (n – 2)f14-underskal för Rn; dessa påverkar dock inte deras kemi på något betydande sätt.