Generic Name: heparin sodium
Dosage Form: injection, solution
Medically reviewed by Drugs.com. Last updated on February 19, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
WARNING:
NOT FOR USE IN NEONATES
Description
SOLUTION IS INTENDED FOR MAINTENANCE OF PATENCY OF INTRAVENOUS INJECTION DEVICES ONLY AND IS NOT TO BE USED FOR ANTICOAGULANT THERAPY.
Heparin Lock Flush Solution, USP is a sterile, nonpyrogenic, hypertonic preparation of heparin sodium injection, USP with sodium chloride in water for injection.
Each milliliter (mL) contains: Heparina sódica, 10 ou 100 unidades de USP (derivada da mucosa intestinal suína); cloreto de sódio 9 mg; edetate dissódico, anidro 0,1 mg adicionado como estabilizador; e álcool benzílico 9 mg adicionado como conservante em água para injeção. Pode conter hidróxido de sódio para ajuste de pH. pH 6,5 (5,0 a 7,5). As concentrações osmolares destas soluções são de 392 mOsmol/L (calc). Retiradas repetidas podem ser feitas do frasco de múltiplas doses.
Heparin Lock Flush Solution, USP é destinado à manutenção da patência de dispositivos de injeção intravenosa apenas e não deve ser usado para terapia anticoagulante.
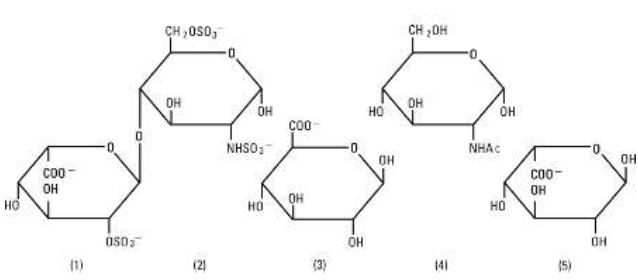
Heparin Sodium, USP é um grupo heterogêneo de mucopolissacarídeos aniônicos de cadeia reta, chamados glicosaminoglicanos com propriedades anticoagulantes. Embora outros possam estar presentes, os principais açúcares que ocorrem na heparina são: (1) ácido a-L-idurônico 2-sulfato, (2) 2-deoxi-2-sulfamino-a-D-glucose 6-sulfato, (3) ácido b-D-glucurônico, (4) 2-acetamido-2-deoxi-a-D-glucose, e (5) ácido a-L-idurônico. Esses açúcares estão presentes em quantidades decrescentes, geralmente na ordem (2)maior que (1)maior que (4)maior que (3)maior que (5), e são unidos por ligações glicosídicas, formando polímeros de tamanhos variados. A heparina é fortemente ácida devido ao seu conteúdo de sulfato covalentemente ligado e grupos de ácido carboxílico. Na heparina sódica, os prótons ácidos das unidades de sulfato são parcialmente substituídos por íons sódio. A potência é determinada por um ensaio biológico usando um padrão de referência USP baseado em unidades de heparina por miligrama.
Estrutura de Heparina Sódica (subunidades representativas):
Cloreto de sódio, USP é quimicamente designado NaCl, um composto cristalino branco livremente solúvel em água. Os frascos semi-rígidos são fabricados a partir de uma poliolefina especialmente formulada. É um copolímero de etileno e propileno. A segurança do plástico foi confirmada por testes em animais de acordo com as normas biológicas USP para recipientes plásticos. O recipiente necessita de
sem barreira de vapor para manter a concentração adequada da droga.
/p>h2>Farmacologia Clínica
Heparina inibe reações que levam à coagulação do sangue e à formação de coágulos de fibrina tanto in vitro como in vivo. A heparina actua em múltiplos locais do sistema de coagulação normal. Pequenas quantidades de heparina em combinação com antitrombina III (cofactor de heparina) podem inibir a trombose através da inactivação do Factor X activado e da inibição da conversão da protrombina em trombina. Uma vez desenvolvida a trombose ativa, maiores quantidades de heparina podem inibir a coagulação, inativando a trombina e impedindo a conversão de fibrinogênio em fibrina. A heparina também previne a formação de um coágulo estável de fibrina ao inibir a ativação do fator estabilizador da fibrina. O tempo de sangramento geralmente não é afetado pela heparina. O tempo de coagulação é prolongado por doses terapêuticas completas de heparina; na maioria dos casos, não é afetado de forma mensurável por baixas doses de heparina. Os pacientes com mais de 60 anos de idade, seguindo doses semelhantes de heparina, podem ter níveis plasmáticos de heparina mais elevados e tempos de tromboplastina parcial ativada (APTTs) mais longos em comparação com pacientes com menos de 60 anos de idade. Os níveis plasmáticos máximos de heparina são alcançados 2 a 4 horas após a administração subcutânea, embora haja variações individuais consideráveis. Os gráficos log-lineares das concentrações plasmáticas de heparina com tempo para uma ampla gama de níveis de dose são lineares o que sugere a ausência de processos de ordem zero. O fígado e o sistema reticuloendotelial são o local de biotransformação. A curva de eliminação bifásica, uma fase alfa em rápido declínio (t½ =10#) e após os 40 anos de idade uma fase beta mais lenta, indica a absorção nos órgãos. A ausência de relação entre meia-vida anticoagulante e concentração de meia-vida pode refletir fatores como a ligação protéica da heparina. A heparina não tem atividade fibrinolítica; portanto, não vai mentir coágulos existentes. A Heparin Lock Flush Solution não induz ação anticoagulante sistêmica em doses únicas de 10 ou 100 unidades USP por mL quando utilizada para manutenção da patência de dispositivos de injeção intravenosa. Pode interferir com testes laboratoriais em amostras de sangue retiradas de tais dispositivos, a menos que o volume de heparina-salina in situ, igual ao volume de primer do cateter, seja aspirado e descartado antes de tais amostras serem coletadas. As concentrações isotônicas de cloreto de sódio são adequadas para reposição parenteral de perdas de cloreto que excedam ou igualem a perda de sódio. As concentrações hipotônicas de cloreto de sódio são adequadas para a manutenção parenteral das necessidades de água quando apenas pequenas quantidades de sal são desejadas.
Cloreto de sódio na água dissocia-se para fornecer íons sódio (Na+) e cloreto (Cl-). O sódio (Na+) é o principal catião do fluido extracelular e desempenha um grande papel na terapia de distúrbios fluidos e eletrólitos. O cloreto (Cl-) tem um papel integral na ação tamponante quando a troca de oxigênio e dióxido de carbono ocorre nos glóbulos vermelhos. A distribuição e excreção do sódio (Na+) estão em grande parte sob o controle do rim, o que mantém um equilíbrio entre a ingestão e a saída. O pequeno volume de fluido e quantidade de cloreto de sódio fornecido pela Solução de Lavagem com Heparina Lock, USP, quando usado apenas como veículo para manter a patência de um dispositivo de injeção intravenosa, é pouco provável que exerça um efeito significativo no equilíbrio de fluido e eletrólitos, exceto possivelmente em bebês muito pequenos.
Indicações e Uso
Heparin Lock Flush Solution, USP é indicado apenas para manter a patência de um dispositivo de injeção intravenosa. Pode ser usado após a colocação inicial do dispositivo na veia, após cada injeção de um medicamento ou após a retirada de sangue para análise laboratorial. A solução não deve ser utilizada para terapia anticoagulante.
Contraindicações
Devido à toxicidade potencial do álcool benzílico em neonatos, soluções contendo álcool benzílico não devem ser utilizadas nesta população de pacientes. As preparações parenterais com álcool benzílico não devem ser usadas para reposição de fluidos ou cloreto de sódio. A heparina sódica não deve ser usada em pacientes: Com hipersensibilidade à heparina; Com um estado de hemorragia activa incontrolável (ver ADVERTÊNCIAS), excepto quando tal se deve à coagulação intravascular disseminada; Com incapacidade de realizar testes de coagulação sanguínea adequados, por exemplo, tempo de coagulação de sangue total, tempo de tromboplastina parcial, etc., a intervalos necessários. Geralmente não há necessidade de monitorar o efeito da heparina em baixas doses em pacientes com parâmetros normais de coagulação.
Avisos
Álcool benzílico, um conservante nas preparações de frascos de múltiplas doses de Heparin Lock Flush Solution, USP tem sido associado com toxicidade em neonatos. O álcool benzílico tem sido relatado como associado a uma “Síndrome de Gaspagem” fetal em bebês prematuros. Não há dados disponíveis sobre a toxicidade de outros conservantes nesta faixa etária. A solução de lavagem sem conservantes Heparin Lock Flush Solution, USP deve ser usada para manter a patência dos dispositivos de injeção intravenosa em recém-nascidos. A Heparin Lock Flush Solution, USP não se destina ao uso intramuscular, anticoagulação sistêmica ou injeção por qualquer via parenteral de administração.
Hypersensibilidade: Pacientes com hipersensibilidade documentada à heparina só devem receber a droga em situações de risco claro de vida.
Hemorragia: A hemorragia pode ocorrer em praticamente qualquer local em pacientes que recebem heparina. Uma queda inexplicável do hematócrito, queda da pressão arterial, ou qualquer outro sintoma inexplicável deve levar à consideração séria de um evento hemorrágico. A heparina sódica deve ser usada com extremo cuidado nos estados patológicos em que há maior perigo de hemorragia. Algumas das condições em que existe maior perigo de hemorragia são:
Cardiovascular- endocardite bacteriana subaguda. Hipertensão arterial severa.
Cirúrgica – Durante e imediatamente após (a) a punção lombar ou anestesia espinhal ou (b) cirurgia maior, especialmente envolvendo o cérebro, medula espinhal ou olho.
Hematológica – Condições associadas com aumento das tendências de sangramento, como hemofilia, trombocitopenia e algumas purpurgias vasculares.
Gastrointestinal – Lesões ulcerativas e drenagem contínua do estômago ou intestino delgado.
Outro – Menstruação, doença hepática com hemostasia comprometida.
Testes de coagulação: Se o teste de coagulação for indevidamente prolongado ou se ocorrer hemorragia, a heparina sódica deve ser descontinuada imediatamente. Soluções de heparina com concentração de 10 Unidades de Heparina USP/mL podem alterar os resultados dos testes de coagulação do sangue. Concentrações de heparina superiores a 10 Unidades de Heparina USP/mL podem alterar os resultados dos testes de coagulação sanguínea.
Trombocitopenia: Foi relatada a ocorrência de trombocitopenia em pacientes que receberam heparina com incidência relatada de 0 a 30%. A trombocitopenia leve (contagem superior a 100.000/mm3) pode permanecer estável ou reverter mesmo que a heparina seja mantida. No entanto, a trombocitopenia de qualquer grau deve ser monitorizada de perto. Se a contagem cair abaixo de 100.000/mm3 ou se a trombose for recorrente
develops (ver White Clot Syndrome, PRECAUTIONS), o produto de heparina deve ser descontinuado. Se a terapia com heparina for essencial, a administração de heparina de uma fonte de órgãos diferente pode ser reintroduzida com cautela. Soluções contendo íons de sódio devem ser usadas com muito cuidado, se for o caso, em pacientes com insuficiência cardíaca congestiva, insuficiência renal grave e em estados clínicos em que exista edema com retenção de sódio.
Precauções
Não usar a menos que a solução esteja clara e o recipiente não esteja danificado. Utilizar técnica asséptica para entrada e retirada de todos os recipientes, simples ou múltipla. Como a heparina sódica neste produto é derivada de tecido animal, deve ser usada com cautela em pacientes com histórico de alergia.
Interferência com testes laboratoriais
Heparina interfere com métodos competitivos de ligação de proteínas para determinações de tiroxina sérica resultando em níveis falsamente elevados. A Heparin Lock Flush Solution pode interferir nas análises laboratoriais ou alterar os resultados de análises químicas do sangue, como glicose, sódio e cloreto séricos, estudos de coagulação do sangue, etc. (Ver FARMACOLOGIA CLÍNICA.) As seguintes informações que dizem respeito ao uso da heparina sódica como anticoagulante sistêmico são incluídas apenas como questão de interesse, uma vez que não é conhecida a sua aplicação no uso do fármaco para a heparina lock.
General:
a. White Clot Syndrome:
Tem sido relatado que pacientes em heparina podem desenvolver nova formação de trombos em associação com trombocitopenia resultante da agregação irreversível de plaquetas induzida pela heparina, a chamada “síndrome do coágulo branco”. O processo pode levar a graves complicações tromboembólicas como necrose da pele, gangrena das extremidades que podem levar à amputação, infarto do miocárdio, embolia pulmonar, acidente vascular cerebral e possivelmente morte. Portanto, a administração de heparina deve ser imediatamente interrompida se um paciente desenvolver nova trombose em associação com trombocitopenia.
b. Resistência à heparina:
Resistência aumentada à heparina é freqüentemente encontrada em febre, trombose, tromboflebite, infecções com tendência trombosante, infarto do miocárdio, câncer e em pacientes pós-cirúrgicos.
c. Aumento do Risco em Pacientes Idosos, Especialmente Mulheres:
Uma maior incidência de sangramento tem sido relatada em pacientes, particularmente mulheres, com mais de 60 anos de idade.
br>p>Interações com Drogas:
As Heparin Lock Flush Solution, USP é destinada apenas para uso na manutenção da patência dos dispositivos de injeção intravenosa, nenhum aditivo deve ser feito em frascos de múltiplas doses.
Anticoagulantes orais: A heparina sódica pode prolongar o tempo de protrombina de um estágio. Portanto, quando a heparina sódica é administrada com dicumarol ou warfarina-sódio, um período de pelo menos 5 horas após a última dose intravenosa deve transcorrer antes que o sangue seja retirado, caso se pretenda obter um tempo válido de PROTHROMBIN.
Inibidores de plaquetas: Drogas como ácido acetilsalicílico, dextrano, fenilbutazona, ibuprofeno, indometacina, dipiridamol, hidroxicloroquina e outras que interferem nas reações de agregação plaquetária (principal defesa hemostática dos pacientes heparinizados) podem induzir sangramento e devem ser usadas com cautela em pacientes que recebem heparina sódica.
Outras interações: Digitalis, tetraciclinas, nicotina, anti-histamínicos ou nitroglicerina intravenosa podem neutralizar parcialmente a ação anticoagulante da heparina sódica.
p>Drug/Laboratory Interactions:
Hiperaminotransferasemia: Elevações significativas dos níveis de aminotransferase (SGOT e SGPT ) ocorreram em uma alta porcentagem de pacientes (e indivíduos saudáveis) que receberam heparina. Como as determinações de aminotransferase são importantes no diagnóstico diferencial de infarto do miocárdio, doença hepática e embolia pulmonar, os aumentos que podem ser causados por drogas (como a heparina) devem ser interpretados com cautela.
Carcinogênese, Mutagênese, Incapacidade de Fertilidade:
Não foram realizados estudos a longo prazo em animais para avaliar o potencial carcinogênico da heparina. Também não foram realizados estudos de reprodução em animais com relação à mutagênese ou comprometimento da fertilidade.
Gravidez:
Efeitos Teratogênicos: Gravidez Categoria C. Estudos de reprodução em animais não foram realizados com heparina sódica ou cloreto de sódio. Também não se sabe se a heparina sódica ou o cloreto de sódio podem causar danos fetais quando administrados a uma mulher grávida ou podem afetar a capacidade reprodutiva. A heparina sódica ou cloreto de sódio só deve ser administrada a uma mulher grávida se for claramente necessário.
Efeitos nãoteratogénicos: A heparina não atravessa a barreira placentária.
p>Mães amamentadoras:
A heparina não é excretada no leite humano.
p>Uso pediátrico:
Segurança e eficácia em pacientes pediátricos não foram estabelecidos. Não para uso em neonatos (ver ADVERTÊNCIAS).
Uso Geriátrico:
Uma maior incidência de sangramento tem sido relatada em pacientes acima de 60 anos de idade, especialmente mulheres (ver PRECAUÇÕES, Geral). Estudos clínicos indicam que doses menores de heparina podem ser indicadas nestes pacientes (ver FARMACOLOGIA CLÍNICA e DOSAGEM E ADMINISTRAÇÃO).
Reações Adversas
Reações adversas à injeção intravenosa intramuscular ou subcutânea de 0.Não é conhecida a ocorrência de álcool benzílico 9% no homem, estudos experimentais de preparados parenterais de pequeno volume contendo álcool benzílico 0,9% em várias espécies de animais indicaram que uma dose intravenosa estimada de até 30 ml pode ser administrada com segurança a um adulto sem efeitos tóxicos. A administração de uma quantidade estimada de 9 mL a 6 kg de álcool é potencialmente capaz de produzir alterações na pressão arterial. Não se sabe se a solução de Heparin Lock Flush Solution causa efeitos locais ou sistêmicos adversos de qualquer tipo. Embora exista uma possibilidade remota de reação de hipersensibilidade com a entrada de quantidades extremamente pequenas da solução subterapêutica na circulação, tal ocorrência não foi relatada.
Dosagem e Administração
Produtos parentéricos devem ser inspecionados visualmente para a detecção de material particulado e descoloração antes da administração, sempre que a solução e o recipiente permitirem. A descoloração ligeira não altera a potência. (Ver PRECAUÇÕES.) A Solução de Lavagem de Heparina Lock, USP 10 ou 100 Unidades USP/mL, é injetada como dose única em um dispositivo de injeção intravenosa usando um volume de solução equivalente ao do dispositivo de punção venosa residente. Uma dose única deve ser injectada após a punção venosa quando o dispositivo residente não deve ser utilizado imediatamente. Após cada utilização
do dispositivo de punção venosa residente para injecção ou infusão de medicação, ou retirada de amostras de sangue, deve ser injectada outra dose para restaurar a eficácia do bloqueio de heparina. A quantidade de solução de heparina é suficiente para evitar a coagulação no lúmen dos dispositivos de punção venosa residentes (geralmente não contendo mais de 0,2 a 0,3 mL) por até vinte e quatro horas. Quando o dispositivo residente é usado para administrar um medicamento incompatível com a heparina, todo o conjunto de bloqueio da heparina deve ser lavado com 0,9% de Cloreto de Sódio, USP antes e depois da administração do medicamento. Após a segunda lavagem, outra dose de solução de heparina deve ser injetada para restaurar a eficácia da heparina bloqueada. Quando o dispositivo residente é utilizado para retirada repetida de amostras de sangue para análises laboratoriais e a presença de heparina ou soro fisiológico é susceptível de interferir ou alterar os resultados dos testes de sangue desejados, a solução de descarga de heparina in situ deve ser removida do dispositivo aspirando e descartando 1 mL antes de ser retirada a amostra de sangue desejada. (See PRECAUTIONS.)
How Supplied
Heparin Lock Flush Solution, USP is supplied in the following dosage forms:
| List No. | Dosage Form | Heparin Sodium (USP Units/mL) |
Solution Volume (mL) |
| 0409-1151-12 | LifeShield Plastic Multple-dose Fliptop vial |
10 | 10 |
| 0409-1151-70 | Plastic Mutliple- dose Fliptop vial |
10 | 10 |
| 0409-1151-78 | Plastic Mutliple- dose Fliptop vial |
10 | 30 |
| 0409-1152-14 | LifeShield Plastic Multple-dose Fliptop vial |
100 | 30 |
| 0409-1152-70 | Plastic Mutliple- dose Fliptop vial |
100 | 10 |
| 0409-1152-78 | Plastic Mutliple- dose Fliptop vial |
100 | 30 |
All of the above may be used with sharp needles. In addition, the LifeShield® products may be used with the LifeShield® Blunt Cannula.
Store at 20° to 25°C (68° to 77°F).
Rev: June 2007
EN-1543
Printed in USA
HOSPIRA, INC., LAKE FOREST, IL 60045 USA
Sample Outer Label

| HEPARIN LOCK FLUSH heparin sodium solution |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – General Injectables & Vaccines, Inc (108250663)
Medical Disclaimer