Generic Name: heparin sodium
Dosage Form: injection, solution
Medically reviewed by Drugs.com. Last updated on February 19, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
WARNING:
NOT FOR USE IN NEONATES
Description
SOLUTION IS INTENDED FOR MAINTENANCE OF PATENCY OF INTRAVENOUS INJECTION DEVICES ONLY AND IS NOT TO BE USED FOR ANTICOAGULANT THERAPY.
Heparin Lock Flush Solution, USP is a sterile, nonpyrogenic, hypertonic preparation of heparin sodium injection, USP with sodium chloride in water for injection.
Each milliliter (mL) contains: Héparine sodique, 10 ou 100 unités USP (dérivée de la muqueuse intestinale porcine) ; chlorure de sodium 9 mg ; édétate disodique, anhydre 0,1 mg ajouté comme stabilisateur ; et alcool benzylique 9 mg ajouté comme conservateur dans de l’eau pour injection. Peut contenir de l’hydroxyde de sodium pour l’ajustement du pH. pH 6,5 (5,0 à 7,5). Les concentrations osmolaires de ces solutions sont de 392 mOsmol/L (calc). Des prélèvements répétés peuvent être effectués à partir du flacon à doses multiples.
La solution Lock Flush à l’héparine, USP est destinée à maintenir la perméabilité des dispositifs d’injection intraveineuse uniquement et ne doit pas être utilisée pour un traitement anticoagulant.
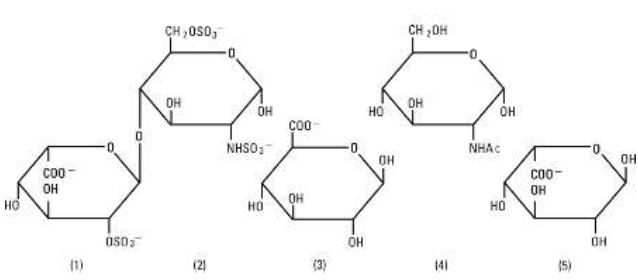
L’héparine sodique, USP est un groupe hétérogène de mucopolysaccharides anioniques à chaîne droite, appelés glycosaminoglycanes ayant des propriétés anticoagulantes. Bien que d’autres puissent être présents, les principaux sucres présents dans l’héparine sont : (1) le 2-sulfate d’acide a-L-iduronique, (2) le 6-sulfate de 2-désoxy-2-sulfamino-a-D-glucose, (3) l’acide b-D-glucuronique, (4) le 2-acétamido-2-désoxy-a-D-glucose et (5) l’acide a-L-iduronique. Ces sucres sont présents en quantités décroissantes, généralement dans l’ordre suivant : (2)plus que(1)plus que(4)plus que(3)plus que(5), et sont reliés par des liaisons glycosidiques, formant des polymères de tailles variables. L’héparine est fortement acide en raison de son contenu en groupes sulfate et acide carboxylique liés de manière covalente. Dans l’héparine sodique, les protons acides des unités sulfate sont partiellement remplacés par des ions sodium. L’activité est déterminée par un test biologique utilisant un standard de référence USP basé sur les unités d’activité de l’héparine par milligramme.
Structure de l’héparine sodique (sous-unités représentatives):
Chlorure de sodium, USP est chimiquement désigné NaCl, un composé cristallin blanc librement soluble dans l’eau. Les flacons semi-rigides sont fabriqués à partir d’une polyoléfine spécialement formulée. Il s’agit d’un copolymère d’éthylène et de propylène. La sécurité du plastique a été confirmée par des tests sur des animaux selon les normes biologiques USP pour les récipients en plastique. Le récipient ne nécessite
aucune barrière de vapeur pour maintenir la bonne concentration du médicament.
Pharmacologie clinique
L’héparine inhibe les réactions qui conduisent à la coagulation du sang et à la formation de caillots de fibrine à la fois in vitro et in vivo. L’héparine agit sur plusieurs sites du système normal de coagulation. De petites quantités d’héparine en association avec l’antithrombine III (cofacteur de l’héparine) peuvent inhiber la thrombose en inactivant le facteur X activé et en inhibant la conversion de la prothrombine en thrombine. Une fois qu’une thrombose active s’est développée, des quantités plus importantes d’héparine peuvent inhiber la poursuite de la coagulation en inactivant la thrombine et en empêchant la conversion du fibrinogène en fibrine. L’héparine empêche également la formation d’un caillot de fibrine stable en inhibant l’activation du facteur de stabilisation de la fibrine. Le temps de saignement n’est généralement pas affecté par l’héparine. Le temps de coagulation est prolongé par des doses thérapeutiques complètes d’héparine ; dans la plupart des cas, il n’est pas affecté de façon mesurable par de faibles doses d’héparine. Chez les patients âgés de plus de 60 ans, après l’administration de doses similaires d’héparine, les taux plasmatiques d’héparine peuvent être plus élevés et les temps de céphaline activée (TCA) plus longs que chez les patients âgés de moins de 60 ans. Les concentrations plasmatiques maximales d’héparine sont atteintes 2 à 4 heures après l’administration sous-cutanée, bien qu’il existe des variations individuelles considérables. Les courbes log-linéaires des concentrations plasmatiques d’héparine en fonction du temps pour une large gamme de doses sont linéaires, ce qui suggère l’absence de processus d’ordre zéro. Le foie et le système réticulo-endothélial sont les sites de biotransformation. La courbe d’élimination biphasique, une phase alpha rapidement décroissante (t½ =10#) et après l’âge de 40 ans une phase bêta plus lente, indique une absorption dans les organes. L’absence de relation entre la demi-vie de l’anticoagulant et la concentration de la demi-vie peut refléter des facteurs tels que la liaison protéique de l’héparine. L’héparine n’a pas d’activité fibrinolytique ; par conséquent, elle ne lysera pas les caillots existants. L’héparine Lock Flush Solution n’exerce pas d’action anticoagulante systémique à des doses uniques de 10 ou 100 unités USP par mL lorsqu’elle est utilisée pour maintenir la perméabilité des dispositifs d’injection intraveineuse. Elle peut interférer avec les tests de laboratoire sur les échantillons de sang prélevés sur ces dispositifs, à moins que le volume d’héparine-saline in situ, égal à celui du volume d’amorçage du cathéter, ne soit aspiré et jeté avant le prélèvement de ces échantillons. Les concentrations isotoniques de chlorure de sodium conviennent pour le remplacement parentéral des pertes de chlorure supérieures ou égales aux pertes de sodium. Les concentrations hypotoniques de chlorure de sodium sont adaptées au maintien parentéral des besoins en eau lorsque seules de petites quantités de sel sont souhaitées.
Le chlorure de sodium dans l’eau se dissocie pour fournir des ions sodium (Na+) et chlorure (Cl-). Le sodium (Na+) est le principal cation du
fluide extracellulaire et joue un rôle important dans la thérapie des troubles liquidiens et électrolytiques. Le chlorure (Cl-) joue un rôle essentiel dans l’action tampon lors des échanges d’oxygène et de dioxyde de carbone dans les globules rouges. La distribution et l’excrétion du sodium (Na+) sont en grande partie sous le contrôle du rein qui maintient un équilibre entre l’apport et la sortie. Le petit volume de liquide et la quantité de chlorure de sodium fournis par Heparin Lock Flush Solution, USP, lorsqu’ils sont utilisés uniquement comme véhicule pour maintenir la perméabilité d’un dispositif d’injection intraveineux, sont peu susceptibles d’exercer un effet significatif sur l’équilibre des liquides et des électrolytes, sauf peut-être chez les très petits nourrissons.
Indications et utilisation
Heparin Lock Flush Solution, USP est indiqué uniquement pour maintenir la perméabilité d’un dispositif d’injection intraveineux. Elle peut être utilisée après la mise en place initiale du dispositif dans la veine, après chaque injection d’un médicament ou après le prélèvement de sang pour une analyse de laboratoire. La solution ne doit pas être utilisée pour un traitement anticoagulant.
Contra-indications
En raison de la toxicité potentielle de l’alcool benzylique chez les nouveau-nés, les solutions contenant de l’alcool benzylique ne doivent pas être utilisées dans cette population de patients. Les préparations parentérales contenant de l’alcool benzylique ne doivent pas être utilisées pour le remplacement des liquides ou du chlorure de sodium. L’héparine sodique ne doit pas être utilisée chez les patients : présentant une hypersensibilité à l’héparine ; présentant un état hémorragique actif incontrôlable (voir MISES EN GARDE), sauf lorsque celui-ci est dû à une coagulation intravasculaire disséminée ; présentant une incapacité à effectuer des tests de coagulation sanguine appropriés, par exemple le temps de coagulation du sang total, le temps de thromboplastine partielle, etc. aux intervalles requis. Il n’est généralement pas nécessaire de surveiller l’effet de l’héparine à faible dose chez les patients dont les paramètres de coagulation sont normaux.
Avertissements
L’alcool benzylique, un agent de conservation présent dans les préparations de flacons à doses multiples de Heparin Lock Flush Solution, USP a été associé à une toxicité chez les nouveau-nés. L’alcool benzylique a été rapporté comme étant associé à un » syndrome de gazage » fœtal chez les enfants prématurés. On ne dispose pas de données sur la toxicité d’autres conservateurs dans ce groupe d’âge. L’Heparin Lock Flush Solution, USP sans conservateur doit être utilisée pour maintenir la perméabilité des dispositifs d’injection intraveineuse chez les nouveau-nés. Heparin Lock Flush Solution, USP n’est pas destiné à une utilisation intramusculaire, à une anticoagulation systémique ou à une injection par une quelconque voie d’administration parentérale.
Hypersensibilité : Les patients présentant une hypersensibilité documentée à l’héparine ne doivent recevoir le médicament que dans des situations mettant clairement leur vie en danger.
Hémorragie : Une hémorragie peut survenir à pratiquement n’importe quel site chez les patients recevant de l’héparine. Une chute inexpliquée de l’hématocrite, une baisse de la pression artérielle ou tout autre symptôme inexpliqué doit conduire à envisager sérieusement un événement hémorragique. L’héparine sodique doit être utilisée avec une extrême prudence dans les états pathologiques où le risque d’hémorragie est accru. Certaines des conditions dans lesquelles il existe un danger accru d’hémorragie sont :
Cardiovasculaire- Endocardite bactérienne subaiguë. Hypertension sévère.
Chirurgical- Pendant et immédiatement après (a) une ponction lombaire ou une anesthésie rachidienne ou (b) une chirurgie majeure, en particulier impliquant le cerveau, la moelle épinière ou l’œil.
Hématologique – Conditions associées à une tendance accrue aux saignements, telles que l’hémophilie, la thrombocytopénie et certains purpuras vasculaires.
Gastro-intestinal – Lésions ulcéreuses et drainage continu par sonde de l’estomac ou de l’intestin grêle.
Other- Menstruations, maladie du foie avec altération de l’hémostase.
Test de coagulation : Si le test de coagulation est indûment prolongé ou si une hémorragie se produit, l’héparine sodique doit être interrompue rapidement. Les solutions d’héparine ayant une concentration de 10 unités d’héparine USP/mL peuvent modifier les résultats des tests de coagulation sanguine. Les concentrations d’héparine supérieures à 10 unités d’héparine USP/mL modifieront les résultats des tests de coagulation sanguine.
Thrombocytopénie : Une thrombocytopénie a été signalée chez les patients recevant de l’héparine avec une incidence rapportée de 0 à 30 %. Une thrombocytopénie légère (numération supérieure à 100 000/mm3) peut rester stable ou s’inverser même si l’héparine est poursuivie. Cependant, la thrombocytopénie, quel que soit son degré, doit être surveillée de près. Si la numération tombe en dessous de 100 000/mm3 ou si une thrombose récurrente se développe (voir Syndrome du caillot blanc, PRÉCAUTIONS), le produit héparinique doit être interrompu. Si la poursuite du traitement par l’héparine est essentielle, l’administration d’héparine provenant d’une autre source organique peut être réintroduite avec prudence. Les solutions contenant des ions sodium doivent être utilisées avec une grande prudence, voire pas du tout, chez les patients souffrant d’insuffisance cardiaque congestive, d’insuffisance rénale sévère et dans les états cliniques dans lesquels il existe un œdème avec rétention de sodium.
Précautions
Ne pas utiliser si la solution n’est pas claire et si le récipient n’est pas endommagé. Utiliser une technique aseptique pour l’entrée et le retrait unique ou multiple de tous les récipients. L’héparine sodique contenue dans ce produit étant dérivée de tissus animaux, elle doit être utilisée avec précaution chez les patients ayant des antécédents d’allergie.
Interférence avec les tests de laboratoire
L’héparine interfère avec les méthodes de liaison aux protéines compétitives pour le dosage de la thyroxine sérique, entraînant des taux faussement élevés. La solution Lock Flush à l’héparine peut interférer avec les analyses de laboratoire ou modifier les résultats des tests de chimie sanguine tels que le glucose, le sodium sérique et le chlorure sérique, les études de coagulation sanguine, etc. (Voir PHARMACOLOGIE CLINIQUE.) Les informations suivantes qui concernent l’utilisation de l’héparine sodique comme anticoagulant systémique sont incluses uniquement à titre d’intérêt car elles ne sont pas connues pour s’appliquer à l’utilisation du médicament pour le verrouillage de l’héparine.
Généralités:
a. Syndrome du caillot blanc:
Il a été rapporté que les patients sous héparine peuvent développer une nouvelle formation de thrombus en association avec une thrombocytopénie résultant de l’agrégation irréversible des plaquettes induite par l’héparine, le soi-disant « syndrome du caillot blanc ». Ce processus peut entraîner des complications thromboemboliques graves telles que la nécrose cutanée, la gangrène des extrémités pouvant conduire à l’amputation, l’infarctus du myocarde, l’embolie pulmonaire, l’accident vasculaire cérébral et éventuellement la mort. Par conséquent, l’administration d’héparine doit être rapidement interrompue si un patient développe une nouvelle thrombose en association avec une thrombocytopénie.
b. Résistance à l’héparine :
Une résistance accrue à l’héparine est fréquemment rencontrée en cas de fièvre, de thrombose, de thrombophlébite, d’infections à tendance thrombosante, d’infarctus du myocarde, de cancer et chez les patients post-chirurgicaux.
c. Risque accru chez les patients âgés, en particulier les femmes :
Une incidence plus élevée de saignements a été signalée chez les patients, en particulier les femmes, âgés de plus de 60 ans.
Interactions médicamenteuses :
Comme la solution de rinçage à l’héparine Lock, USP est destinée uniquement à être utilisée pour maintenir la perméabilité des dispositifs d’injection intraveineuse, aucun additif ne doit être apporté aux flacons à doses multiples.
Anticoagulants oraux : L’héparine sodique peut prolonger le temps de prothrombine en une étape. Par conséquent, lorsque l’héparine sodique est administrée avec du dicumarol ou de la warfarine sodique, une période d’au moins 5 heures après la dernière dose intraveineuse doit s’écouler avant le prélèvement de sang si l’on veut obtenir un temps de PROTHROMBINE valide.
Inhibiteurs plaquettaires : Les médicaments tels que l’acide acétylsalicylique, le dextran, la phénylbutazone, l’ibuprofène, l’indométhacine, le dipyridamole, l’hydroxychloroquine et d’autres qui interfèrent avec les réactions d’agrégation plaquettaire (la principale défense hémostatique des patients héparinés) peuvent induire des saignements et doivent être utilisés avec prudence chez les patients recevant de l’héparine sodique.
Autres interactions : Les digitaliques, les tétracyclines, la nicotine, les anti-histaminiques ou la nitroglycérine par voie intraveineuse peuvent contrecarrer partiellement l’action anticoagulante de l’héparine sodique.
Interactions médicamenteuses et de laboratoire :
Hyperaminotransférase : Des élévations significatives des taux d’aminotransférase (SGOT et SGPT ) sont survenues chez un pourcentage élevé de patients (et de sujets sains) ayant reçu de l’héparine. Comme les déterminations des aminotransférases sont importantes dans le diagnostic différentiel de l’infarctus du myocarde, des maladies hépatiques et des embolies pulmonaires, les élévations qui pourraient être causées par des médicaments (comme l’héparine) doivent être interprétées avec prudence.
Carcinogenèse, mutagenèse, altération de la fertilité:
Aucune étude à long terme chez l’animal n’a été réalisée pour évaluer le potentiel cancérigène de l’héparine. De même, aucune étude de reproduction chez l’animal n’a été réalisée concernant la mutagenèse ou l’altération de la fertilité.
Grossesse :
Effets tératogènes : Grossesse catégorie C. Aucune étude de reproduction chez l’animal n’a été réalisée avec l’héparine sodique ou le chlorure de sodium. On ne sait pas non plus si l’héparine sodique ou le chlorure de sodium peuvent causer des dommages au fœtus lorsqu’ils sont administrés à une femme enceinte ou peuvent affecter la capacité de reproduction. L’héparine sodique ou le chlorure de sodium ne doivent être administrés à une femme enceinte que si cela est clairement nécessaire.
Effets non montératogènes : L’héparine ne traverse pas la barrière placentaire.
Mères allaitantes :
L’héparine n’est pas excrétée dans le lait maternel.
Utilisation pédiatrique :
La sécurité et l’efficacité chez les patients pédiatriques n’ont pas été établies. Ne pas utiliser chez les nouveau-nés (voir MISES EN GARDE).
Utilisation gériatrique:
Une incidence plus élevée de saignements a été signalée chez les patients âgés de plus de 60 ans, en particulier chez les femmes (voir PRÉCAUTIONS, Généralités). Les études cliniques indiquent que des doses plus faibles d’héparine peuvent être indiquées chez ces patients (voir PHARMACOLOGIE CLINIQUE et POSOLOGIE ET ADMINISTRATION).
Réactions indésirables
Bien que des réactions indésirables à l’injection intraveineuse intramusculaire ou sous-cutanée d’alcool benzylique à 0.9% d’alcool benzylique ne soient pas connues chez l’homme, des études expérimentales de préparations parentérales de petit volume contenant de l’alcool benzylique à 0,9% chez plusieurs espèces animales ont indiqué qu’une dose intraveineuse estimée jusqu’à 30 mL peut être administrée en toute sécurité à un adulte sans effets toxiques. L’administration d’une dose estimée à 9 ml à un enfant de 6 kg peut potentiellement entraîner des modifications de la pression artérielle. L’héparine Lock Flush Solution n’est pas connue pour provoquer des effets indésirables locaux ou systémiques d’aucune sorte. Bien qu’une faible possibilité de réaction d’hypersensibilité existe avec l’entrée de quantités subthérapeutiques extrêmement faibles de la solution dans la circulation, une telle occurrence n’a pas été rapportée.
Dosage et administration
Les produits pharmaceutiques parentéraux doivent être inspectés visuellement pour détecter les particules et la décoloration avant l’administration, chaque fois que la solution et le récipient le permettent. Une légère décoloration n’altère pas l’activité du médicament. (Voir PRÉCAUTIONS.) L’héparine Lock Flush Solution, USP 10 ou 100 unités USP/mL, est injectée en une seule dose dans un dispositif d’injection intraveineuse en utilisant un volume de solution équivalent à celui du dispositif de ponction veineuse à demeure. Une dose unique doit être injectée après la ponction veineuse lorsque le dispositif à demeure ne doit pas être utilisé immédiatement. Après chaque utilisation du dispositif de ponction veineuse à demeure pour l’injection ou la perfusion de médicaments, ou le prélèvement d’échantillons sanguins, une autre dose doit être injectée pour rétablir l’efficacité du verrou héparinique. La quantité de solution d’héparine est suffisante pour empêcher la formation de caillots dans la lumière du dispositif de ponction veineuse à demeure (ne contenant généralement pas plus de 0,2 à 0,3 ml) pendant une période pouvant aller jusqu’à vingt-quatre heures. Lorsque le dispositif à demeure est utilisé pour administrer un médicament incompatible avec l’héparine, il faut rincer l’ensemble du dispositif à demeure avec du chlorure de sodium injectable à 0,9 %, USP avant et après l’administration du médicament. Après le deuxième rinçage, une autre dose de solution d’héparine doit être injectée pour rétablir l’efficacité du verrou héparinique. Lorsque le dispositif à demeure est utilisé pour des prélèvements répétés d’échantillons sanguins pour des analyses de laboratoire et que la présence d’héparine ou de solution saline est susceptible d’interférer avec les résultats des tests sanguins souhaités ou de les modifier, la solution de rinçage à l’héparine in situ doit être éliminée du dispositif en aspirant et en jetant 1 mL avant le prélèvement de l’échantillon sanguin souhaité. (See PRECAUTIONS.)
How Supplied
Heparin Lock Flush Solution, USP is supplied in the following dosage forms:
| List No. | Dosage Form | Heparin Sodium (USP Units/mL) |
Solution Volume (mL) |
| 0409-1151-12 | LifeShield Plastic Multple-dose Fliptop vial |
10 | 10 |
| 0409-1151-70 | Plastic Mutliple- dose Fliptop vial |
10 | 10 |
| 0409-1151-78 | Plastic Mutliple- dose Fliptop vial |
10 | 30 |
| 0409-1152-14 | LifeShield Plastic Multple-dose Fliptop vial |
100 | 30 |
| 0409-1152-70 | Plastic Mutliple- dose Fliptop vial |
100 | 10 |
| 0409-1152-78 | Plastic Mutliple- dose Fliptop vial |
100 | 30 |
All of the above may be used with sharp needles. In addition, the LifeShield® products may be used with the LifeShield® Blunt Cannula.
Store at 20° to 25°C (68° to 77°F).
Rev: June 2007
EN-1543
Printed in USA
HOSPIRA, INC., LAKE FOREST, IL 60045 USA
Sample Outer Label

| HEPARIN LOCK FLUSH heparin sodium solution |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – General Injectables & Vaccines, Inc (108250663)
Medical Disclaimer