Generic Name: heparin sodium
Dosage Form: injection, solution
Medically reviewed by Drugs.com. Last updated on February 19, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
WARNING:
NOT FOR USE IN NEONATES
Description
SOLUTION IS INTENDED FOR MAINTENANCE OF PATENCY OF INTRAVENOUS INJECTION DEVICES ONLY AND IS NOT TO BE USED FOR ANTICOAGULANT THERAPY.
Heparin Lock Flush Solution, USP is a sterile, nonpyrogenic, hypertonic preparation of heparin sodium injection, USP with sodium chloride in water for injection.
Each milliliter (mL) contains: Heparin-Natrium, 10 oder 100 USP-Einheiten (aus Schweinedarmschleimhaut); Natriumchlorid 9 mg; Edetat-Natrium, wasserfrei 0,1 mg als Stabilisator; und Benzylalkohol 9 mg als Konservierungsmittel in Wasser für Injektionszwecke. Kann Natriumhydroxid zur pH-Einstellung enthalten. pH 6,5 (5,0 bis 7,5). Die osmolaren Konzentrationen dieser Lösungen betragen 392 mOsmol/L (calc). Heparin Lock Flush Solution, USP, ist nur für die Aufrechterhaltung der Durchgängigkeit von intravenösen Injektionsvorrichtungen bestimmt und darf nicht für eine gerinnungshemmende Therapie verwendet werden.
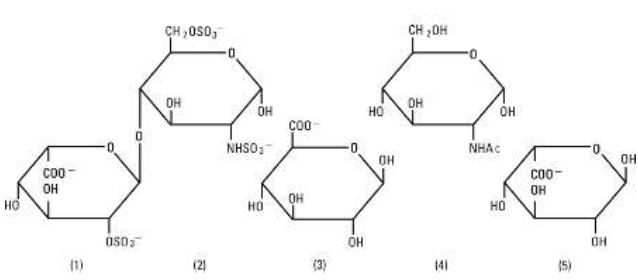
Heparin-Natrium, USP, ist eine heterogene Gruppe von geradkettigen anionischen Mucopolysacchariden, die als Glykosaminoglykane mit gerinnungshemmenden Eigenschaften bezeichnet werden. Obwohl auch andere Zuckerarten vorhanden sein können, sind die wichtigsten in Heparin vorkommenden Zuckerarten: (1) a-L-Iduronsäure-2-sulfat, (2) 2-Desoxy-2-sulfamino-a-D-glucose-6-sulfat, (3) b-D-Glucuronsäure, (4) 2-Acetamido-2-desoxy-a-D-glucose und (5) a-L-Iduronsäure. Diese Zucker sind in abnehmenden Mengen vorhanden, in der Regel in der Reihenfolge (2) größer als (1) größer als (4) größer als (3) größer als (5), und sind durch glykosidische Bindungen verbunden, die Polymere unterschiedlicher Größe bilden. Heparin ist aufgrund seines Gehalts an kovalent gebundenen Sulfat- und Carbonsäuregruppen stark sauer. In Heparin-Natrium sind die sauren Protonen der Sulfateinheiten teilweise durch Natriumionen ersetzt. Die Wirksamkeit wird durch einen biologischen Test unter Verwendung eines USP-Referenzstandards auf der Grundlage von Einheiten der Heparinaktivität pro Milligramm bestimmt.
Struktur von Heparin-Natrium (repräsentative Untereinheiten):
Natriumchlorid, USP, wird chemisch als NaCl bezeichnet und ist eine weiße kristalline Verbindung, die frei in Wasser löslich ist. Die halbstarren Fläschchen werden aus einem speziell formulierten Polyolefin hergestellt. Es handelt sich um ein Copolymer aus Ethylen und Propylen. Die Sicherheit des Kunststoffs wurde durch Tierversuche gemäß den biologischen USP-Normen für Kunststoffbehälter bestätigt. Der Behälter benötigt
keine Dampfsperre, um die richtige Wirkstoffkonzentration aufrechtzuerhalten.
Klinische Pharmakologie
Heparin hemmt Reaktionen, die zur Blutgerinnung und zur Bildung von Fibringerinnseln führen, sowohl in vitro als auch in vivo. Heparin wirkt an mehreren Stellen des normalen Gerinnungssystems. Geringe Mengen von Heparin in Kombination mit Antithrombin III (Heparin-Cofaktor) können die Thrombose hemmen, indem sie den aktivierten Faktor X inaktivieren und die Umwandlung von Prothrombin in Thrombin hemmen. Wenn sich eine aktive Thrombose entwickelt hat, können größere Mengen von Heparin die weitere Gerinnung hemmen, indem sie Thrombin inaktivieren und die Umwandlung von Fibrinogen in Fibrin verhindern. Heparin verhindert auch die Bildung eines stabilen Fibringerinnsels, indem es die Aktivierung des fibrinstabilisierenden Faktors hemmt. Die Blutungszeit wird durch Heparin in der Regel nicht beeinträchtigt. Die Gerinnungszeit wird durch volle therapeutische Dosen von Heparin verlängert; in den meisten Fällen wird sie durch niedrige Heparin-Dosen nicht messbar beeinflusst. Bei Patienten über 60 Jahren können nach einer ähnlichen Heparindosis höhere Plasmaspiegel von Heparin und längere aktivierte partielle Thromboplastinzeiten (APTTs) auftreten als bei Patienten unter 60 Jahren. Die Spitzenplasmaspiegel von Heparin werden 2 bis 4 Stunden nach der subkutanen Verabreichung erreicht, obwohl es erhebliche individuelle Unterschiede gibt. Die logarithmischen Darstellungen der Heparin-Plasmakonzentrationen in Abhängigkeit von der Zeit für einen breiten Bereich von Dosierungen sind linear, was auf das Fehlen von Prozessen nullter Ordnung schließen lässt. Die Leber und das retikuloendotheliale System sind die Orte der Biotransformation. Die biphasische Eliminationskurve, eine schnell abfallende Alpha-Phase (t½ =10#) und nach dem 40. Lebensjahr eine langsamere Beta-Phase, weist auf die Aufnahme in die Organe hin. Das Fehlen einer Beziehung zwischen der Halbwertszeit des Gerinnungshemmers und der Konzentration der Halbwertszeit kann auf Faktoren wie die Proteinbindung von Heparin zurückzuführen sein. Heparin hat keine fibrinolytische Aktivität; daher löst es bestehende Gerinnsel nicht auf. Heparin Lock Flush Solution hat bei Einzeldosen von 10 oder 100 USP-Einheiten pro ml keine systemische gerinnungshemmende Wirkung, wenn es zur Aufrechterhaltung der Durchgängigkeit von intravenösen Injektionsgeräten verwendet wird. Sie kann Labortests mit Blutproben, die aus solchen Vorrichtungen entnommen wurden, beeinträchtigen, es sei denn, das Volumen der In-situ-Heparin-Salzlösung, das dem Füllvolumen des Katheters entspricht, wird vor der Entnahme solcher Proben abgesaugt und verworfen. Isotonische Konzentrationen von Natriumchlorid eignen sich für den parenteralen Ersatz von Chloridverlusten, die den Natriumverlust übersteigen oder ihm entsprechen. Hypotone Natriumchlorid-Konzentrationen eignen sich für die parenterale Deckung des Wasserbedarfs, wenn nur geringe Salzmengen benötigt werden.
Natriumchlorid dissoziiert in Wasser zu Natrium- (Na+) und Chlorid-Ionen (Cl-). Natrium (Na+) ist das Hauptkation der
extrazellulären Flüssigkeit und spielt eine große Rolle bei der Therapie von Flüssigkeits- und Elektrolytstörungen. Chlorid (Cl-) spielt eine wesentliche Rolle bei der Pufferung beim Austausch von Sauerstoff und Kohlendioxid in den roten Blutkörperchen. Die Verteilung und Ausscheidung von Natrium (Na+) unterliegt weitgehend der Kontrolle der Niere, die ein Gleichgewicht zwischen Aufnahme und Abgabe aufrechterhält. Das geringe Flüssigkeitsvolumen und die geringe Menge an Natriumchlorid, die von Heparin Lock Flush Solution, USP, zur Verfügung gestellt werden, wenn sie nur als Vehikel zur Aufrechterhaltung der Durchgängigkeit einer intravenösen Injektionsvorrichtung verwendet werden, haben wahrscheinlich keinen signifikanten Einfluss auf den Flüssigkeits- und Elektrolythaushalt, außer möglicherweise bei sehr kleinen Säuglingen.
Indikationen und Anwendung
Heparin Lock Flush Solution, USP ist nur zur Aufrechterhaltung der Durchgängigkeit einer intravenösen Injektionsvorrichtung indiziert. Sie kann nach dem erstmaligen Einsetzen der Vorrichtung in die Vene, nach jeder Injektion eines Medikaments oder nach der Entnahme von Blut für Laboranalysen verwendet werden. Die Lösung darf nicht zur Antikoagulationstherapie verwendet werden.
Kontraindikationen
Aufgrund der möglichen Toxizität von Benzylalkohol bei Neugeborenen dürfen benzylalkoholhaltige Lösungen bei dieser Patientengruppe nicht verwendet werden. Parenterale Zubereitungen mit Benzylalkohol sollten nicht zum Flüssigkeits- oder Natriumchloridersatz verwendet werden. Heparin-Natrium sollte bei Patienten nicht angewendet werden: Bei Überempfindlichkeit gegen Heparin; bei unkontrollierbaren aktiven Blutungen (siehe WARNHINWEISE), außer wenn diese auf eine disseminierte intravasale Gerinnung zurückzuführen sind; bei Unfähigkeit, geeignete Blutgerinnungstests, z. B. Vollblutgerinnungszeit, partielle Thromboplastinzeit usw., in den erforderlichen Abständen durchzuführen. Bei Patienten mit normalen Gerinnungsparametern ist es in der Regel nicht erforderlich, die Wirkung von niedrig dosiertem Heparin zu überwachen.
Warnhinweise
Benzylalkohol, ein Konservierungsmittel in den Mehrfachdosis-Flaschenzubereitungen von Heparin Lock Flush Solution, USP, wurde mit Toxizität bei Neugeborenen in Verbindung gebracht. Es wurde berichtet, dass Benzylalkohol bei Frühgeborenen mit einem fetalen „Gasping-Syndrom“ in Verbindung gebracht wird. Über die Toxizität anderer Konservierungsstoffe in dieser Altersgruppe liegen keine Daten vor. Konservierungsmittelfreie Heparin Lock Flush Solution, USP sollte zur Aufrechterhaltung der Durchgängigkeit von intravenösen Injektionsgeräten bei Neugeborenen verwendet werden. Heparin Lock Flush Solution, USP ist nicht für die intramuskuläre Anwendung, die systemische Antikoagulation oder die Injektion über einen parenteralen Verabreichungsweg bestimmt.
Überempfindlichkeit: Patienten mit nachgewiesener Überempfindlichkeit gegen Heparin sollten das Arzneimittel nur in eindeutig lebensbedrohlichen Situationen erhalten.
Blutungen: Bei Patienten, die Heparin erhalten, können Blutungen an praktisch jeder Stelle auftreten. Ein unerklärlicher Abfall des Hämatokrits, ein Blutdruckabfall oder ein anderes unerklärliches Symptom sollte zu einer ernsthaften Erwägung eines hämorrhagischen Ereignisses führen. Heparin-Natrium sollte mit äußerster Vorsicht bei Krankheitszuständen angewendet werden, bei denen eine erhöhte Gefahr von Blutungen besteht. Einige der Zustände, bei denen eine erhöhte Blutungsgefahr besteht, sind:
Kardiovaskulär- Subakute bakterielle Endokarditis. Schwere Hypertonie.
Chirurgisch- Während und unmittelbar nach (a) Lumbalpunktion oder Spinalanästhesie oder (b) größeren Operationen, insbesondere am Gehirn, Rückenmark oder Auge.
Hämatologisch- Zustände, die mit erhöhter Blutungsneigung einhergehen, wie Hämophilie, Thrombozytopenie und einige vaskuläre Purpuren.
Gastrointestinal – Ulzerative Läsionen und kontinuierliche Sondenentwässerung des Magens oder Dünndarms.
Sonstiges – Menstruation, Lebererkrankungen mit beeinträchtigter Hämostase.
Gerinnungstests: Wenn der Gerinnungstest übermäßig verlängert ist oder wenn Blutungen auftreten, sollte Heparin-Natrium sofort abgesetzt werden. Heparinlösungen mit einer Konzentration von 10 USP Heparineinheiten/ml können die Ergebnisse von Blutgerinnungstests verändern. Heparinkonzentrationen von mehr als 10 USP Heparineinheiten/ml können die Ergebnisse von Blutgerinnungstests verändern.
Thrombozytopenie: Es wurde berichtet, dass bei Patienten, die Heparin erhalten, eine Thrombozytopenie mit einer Inzidenz von 0 bis 30 % auftritt. Eine leichte Thrombozytopenie (Anzahl größer als 100.000/mm3) kann stabil bleiben oder sich zurückbilden, auch wenn Heparin fortgesetzt wird. Eine Thrombozytopenie jeglichen Ausmaßes sollte jedoch genau überwacht werden. Wenn die Thrombozytenzahl unter 100.000/mm3 fällt oder sich eine rezidivierende Thrombose entwickelt (siehe Weißes Gerinnsel-Syndrom, VORSICHTSMASSNAHMEN), sollte das Heparinpräparat abgesetzt werden. Wenn eine fortgesetzte Heparintherapie unerlässlich ist, kann die Verabreichung von Heparin aus einer anderen Organquelle mit Vorsicht wieder aufgenommen werden. Natriumionen enthaltende Lösungen sollten, wenn überhaupt, nur mit großer Vorsicht bei Patienten mit kongestiver Herzinsuffizienz, schwerer Niereninsuffizienz und bei klinischen Zuständen, in denen Ödeme mit Natriumretention bestehen, verwendet werden.
Vorsichtsmaßnahmen
Nur verwenden, wenn die Lösung klar und der Behälter unbeschädigt ist. Verwenden Sie aseptische Techniken für die einmalige oder mehrfache Eingabe und Entnahme aus allen Behältern. Da das Heparin-Natrium in diesem Produkt aus tierischem Gewebe gewonnen wird, sollte es bei Patienten mit einer Allergie in der Vorgeschichte mit Vorsicht angewendet werden.
Beeinflussung von Labortests
Heparin beeinträchtigt kompetitive Proteinbindungsmethoden für die Bestimmung von Serumthyroxin, was zu falsch erhöhten Werten führt. Heparin Lock Flush Solution kann Laboranalysen beeinträchtigen oder die Ergebnisse von blutchemischen Tests wie Glukose, Serumnatrium und Serumchlorid, Blutgerinnungsstudien usw. verändern. (Siehe KLINISCHE PHARMAKOLOGIE.) Die folgenden Informationen, die sich auf die Anwendung von Heparin-Natrium als systemisches Antikoagulans beziehen, sind nur von Interesse, da nicht bekannt ist, dass sie auf die Anwendung des Arzneimittels für Heparin Lock zutreffen.
Allgemein:
a. White-Clot-Syndrom:
Es wurde berichtet, dass Patienten, die Heparin erhalten, in Verbindung mit einer Thrombozytopenie neue Thromben bilden können, die aus einer irreversiblen, durch Heparin induzierten Aggregation von Blutplättchen resultieren, dem sogenannten „White-Clot-Syndrom“. Dieser Prozess kann zu schweren thromboembolischen Komplikationen wie Hautnekrosen, Gangrän der Extremitäten, die zu Amputationen führen können, Myokardinfarkt, Lungenembolie, Schlaganfall und möglicherweise zum Tod führen. Daher sollte die Heparinverabreichung sofort abgesetzt werden, wenn ein Patient eine neue Thrombose in Verbindung mit einer Thrombozytopenie entwickelt.
b. Heparinresistenz:
Eine erhöhte Heparinresistenz tritt häufig bei Fieber, Thrombose, Thrombophlebitis, Infektionen mit Thromboseneigung, Myokardinfarkt, Krebs und bei Patienten nach Operationen auf.
c. Erhöhtes Risiko bei älteren Patienten, insbesondere bei Frauen:
Bei Patienten, insbesondere bei Frauen, die älter als 60 Jahre sind, wurde über ein erhöhtes Auftreten von Blutungen berichtet.
Wechselwirkungen mit Arzneimitteln:
Da Heparin Lock Flush Solution, USP nur zur Aufrechterhaltung der Durchgängigkeit von intravenösen Injektionsvorrichtungen bestimmt ist, sollten keine Zusätze zu Mehrfachdosis-Fläschchen gemacht werden.
Orale Antikoagulanzien: Heparin-Natrium kann die einstufige Prothrombinzeit verlängern. Wenn Heparin-Natrium zusammen mit Dicumarol oder Warfarin-Natrium verabreicht wird, sollten daher mindestens 5 Stunden nach der letzten intravenösen Dosis vergehen, bevor Blut entnommen wird, wenn eine gültige PROTHROMBIN-Zeit erhalten werden soll.
Plättchenhemmer: Medikamente wie Acetylsalicylsäure, Dextran, Phenylbutazon, Ibuprofen, Indomethacin, Dipyridamol, Hydroxychloroquin und andere, die die Thrombozytenaggregationsreaktionen (die wichtigste hämostatische Abwehr von heparinisierten Patienten) stören, können Blutungen auslösen und sollten bei Patienten, die Heparin-Natrium erhalten, mit Vorsicht angewendet werden.
Weitere Wechselwirkungen: Digitalis, Tetracycline, Nikotin, Antihistaminika oder Nitroglycerin zur intravenösen Verabreichung können der gerinnungshemmenden Wirkung von Heparin-Natrium teilweise entgegenwirken.
Arzneimittel/Laborinteraktionen:
Hyperaminotransferämie: Bei einem hohen Prozentsatz von Patienten (und gesunden Probanden), die Heparin erhalten haben, sind signifikante Erhöhungen der Aminotransferase (SGOT und SGPT ) aufgetreten. Da Aminotransferase-Bestimmungen bei der Differentialdiagnose von Herzinfarkt, Lebererkrankungen und Lungenembolien wichtig sind, sollten Erhöhungen, die durch Arzneimittel (wie Heparin) verursacht werden könnten, mit Vorsicht interpretiert werden.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit:
Es wurden keine Langzeitstudien an Tieren durchgeführt, um das karzinogene Potenzial von Heparin zu bewerten. Es wurden auch keine Reproduktionsstudien an Tieren zur Mutagenese oder Beeinträchtigung der Fertilität durchgeführt.
Schwangerschaft:
Teratogene Wirkungen: Schwangerschaftskategorie C. Tierische Reproduktionsstudien sind mit Heparin-Natrium oder Natriumchlorid nicht durchgeführt worden. Es ist auch nicht bekannt, ob Heparin-Natrium oder Natriumchlorid bei der Verabreichung an eine schwangere Frau fötale Schäden verursachen oder die Fortpflanzungsfähigkeit beeinträchtigen kann. Heparin-Natrium oder Natriumchlorid sollte einer schwangeren Frau nur bei eindeutigem Bedarf verabreicht werden.
Nicht-teratogene Wirkungen: Heparin passiert die Plazentaschranke nicht.
Stillende Mütter:
Heparin wird nicht in die Muttermilch ausgeschieden.
Pädiatrische Anwendung:
Sicherheit und Wirksamkeit bei pädiatrischen Patienten sind nicht nachgewiesen. Nicht zur Anwendung bei Neugeborenen (siehe WARNHINWEISE).
Geriatrische Anwendung:
Bei Patienten über 60 Jahren, insbesondere bei Frauen, wurde über ein erhöhtes Auftreten von Blutungen berichtet (siehe VORSICHTSMASSNAHMEN, Allgemeines). Klinische Studien deuten darauf hin, dass bei diesen Patienten niedrigere Heparindosen angezeigt sein können (siehe KLINISCHE PHARMAKOLOGIE und DOSIERUNG UND ANWENDUNG).
Nebenwirkungen
Obwohl Nebenwirkungen der intravenösen, intramuskulären oder subkutanen Injektion von 0.9%igen Benzylalkohol beim Menschen nicht bekannt sind, haben experimentelle Studien mit kleinvolumigen parenteralen Zubereitungen, die 0,9%igen Benzylalkohol enthalten, an verschiedenen Tierarten gezeigt, dass eine geschätzte intravenöse Dosis von bis zu 30 ml einem Erwachsenen sicher und ohne toxische Wirkungen verabreicht werden kann. Die Verabreichung einer geschätzten Menge von 9 ml an einen 6 kg schweren Säugling kann möglicherweise zu Blutdruckveränderungen führen. Es ist nicht bekannt, dass Heparin Lock Flush Lösung irgendwelche nachteiligen lokalen oder systemischen Wirkungen verursacht. Obwohl die entfernte Möglichkeit einer Überempfindlichkeitsreaktion besteht, wenn extrem kleine subtherapeutische Mengen der Lösung in den Blutkreislauf gelangen, wurde über ein solches Ereignis nicht berichtet.
Dosierung und Verabreichung
Parenteralpräparate sollten vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden, sofern Lösung und Behältnis dies erlauben. Leichte Verfärbungen verändern die Wirksamkeit nicht. (Siehe VORSICHTSMASSNAHMEN.) Heparin Lock Flush Solution, USP 10 oder 100 USP-Einheiten/ml, wird als Einzeldosis in eine intravenöse Injektionsvorrichtung injiziert, wobei ein Lösungsvolumen verwendet wird, das dem der Venenverweilvorrichtung entspricht. Eine Einzeldosis sollte nach der Venenpunktion injiziert werden, wenn die Venenverweilkanüle nicht sofort verwendet werden soll. Nach jeder Verwendung
der Venenverweilkanüle zur Injektion oder Infusion von Medikamenten oder zur Entnahme von Blutproben sollte eine weitere Dosis injiziert werden, um die Wirksamkeit der Heparinsperre wiederherzustellen. Die Menge der Heparinlösung reicht aus, um eine Gerinnung im Lumen der Venenverweilkanüle zu verhindern (in der Regel nicht mehr als 0,2 bis 0,3 ml), und zwar bis zu vierundzwanzig Stunden lang. Wenn die Verweilvorrichtung zur Verabreichung eines mit Heparin unverträglichen Arzneimittels verwendet wird, sollte das gesamte Heparin-Lock-Set vor und nach der Verabreichung des Medikaments mit 0,9 % Natriumchlorid-Injektion, USP, gespült werden. Nach der zweiten Spülung sollte eine weitere Dosis Heparinlösung injiziert werden, um die Wirksamkeit der Heparinsperre wiederherzustellen. Wenn die Verweilvorrichtung zur wiederholten Entnahme von Blutproben für Laboranalysen verwendet wird und das Vorhandensein von Heparin oder Kochsalzlösung die Ergebnisse der gewünschten Bluttests beeinträchtigen oder verändern könnte, sollte die In-situ-Heparinspüllösung aus der Vorrichtung entfernt werden, indem 1 ml abgesaugt und verworfen wird, bevor die gewünschte Blutprobe entnommen wird. (See PRECAUTIONS.)
How Supplied
Heparin Lock Flush Solution, USP is supplied in the following dosage forms:
| List No. | Dosage Form | Heparin Sodium (USP Units/mL) |
Solution Volume (mL) |
| 0409-1151-12 | LifeShield Plastic Multple-dose Fliptop vial |
10 | 10 |
| 0409-1151-70 | Plastic Mutliple- dose Fliptop vial |
10 | 10 |
| 0409-1151-78 | Plastic Mutliple- dose Fliptop vial |
10 | 30 |
| 0409-1152-14 | LifeShield Plastic Multple-dose Fliptop vial |
100 | 30 |
| 0409-1152-70 | Plastic Mutliple- dose Fliptop vial |
100 | 10 |
| 0409-1152-78 | Plastic Mutliple- dose Fliptop vial |
100 | 30 |
All of the above may be used with sharp needles. In addition, the LifeShield® products may be used with the LifeShield® Blunt Cannula.
Store at 20° to 25°C (68° to 77°F).
Rev: June 2007
EN-1543
Printed in USA
HOSPIRA, INC., LAKE FOREST, IL 60045 USA
Sample Outer Label

| HEPARIN LOCK FLUSH heparin sodium solution |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – General Injectables & Vaccines, Inc (108250663)
Medical Disclaimer