Generic Name: heparin sodium
Dosage Form: injection, solution
Medically reviewed by Drugs.com. Last updated on February 19, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
WARNING:
NOT FOR USE IN NEONATES
Description
SOLUTION IS INTENDED FOR MAINTENANCE OF PATENCY OF INTRAVENOUS INJECTION DEVICES ONLY AND IS NOT TO BE USED FOR ANTICOAGULANT THERAPY.
Heparin Lock Flush Solution, USP is a sterile, nonpyrogenic, hypertonic preparation of heparin sodium injection, USP with sodium chloride in water for injection.
Each milliliter (mL) contains: Heparinnatrium, 10 eller 100 USP-enheter (härrör från tarmslemhinna från svin), natriumklorid 9 mg, edetatdinatrium, vattenfri 0,1 mg tillsatt som stabiliseringsmedel och bensylalkohol 9 mg tillsatt som konserveringsmedel i vatten för injektion. Kan innehålla natriumhydroxid för pH-justering. pH 6,5 (5,0 till 7,5). De osmolära koncentrationerna i dessa lösningar är 392 mOsmol/L (calc). Upprepade uttag kan göras från flerdosinflaskan.
Heparin Lock Flush Solution, USP är endast avsedd för upprätthållande av genomsläpplighet av intravenösa injektionsanordningar och ska inte användas för antikoagulantiabehandling.
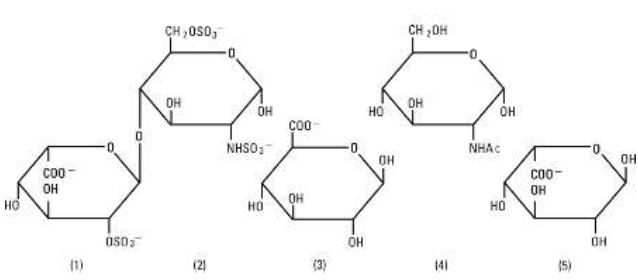
Heparin Sodium, USP är en heterogen grupp av raka anjoniska mukopolysackarider med anjonisk kedja, så kallade glykosaminoglykaner som har antikoagulerande egenskaper. Även om andra kan förekomma, är de viktigaste sockerarter som förekommer i heparin: (1) a-L-iduronsyra 2-sulfat, (2) 2-deoxy-2-sulfamino-a-D-glukos 6-sulfat, (3) b-D-glukuronsyra, (4) 2-acetamido-2-deoxy-a-D-glukos och (5) a-L-iduronsyra. Dessa sockerarter förekommer i minskande mängder, vanligen i ordningen (2)större än(1)större än(4)större än(3)större än(5), och är förenade genom glykosidiska bindningar och bildar polymerer av varierande storlek. Heparin är starkt surt på grund av sitt innehåll av kovalent länkade sulfat- och karboxylsyregrupper. I heparinnatrium är de sura protonerna i sulfatenheterna delvis ersatta av natriumjoner. Styrkan bestäms genom en biologisk analys med hjälp av en USP-referensstandard baserad på enheter av heparinaktivitet per milligram.
Struktur av heparinnatrium (representativa underenheter):
Natriumklorid, USP har den kemiska beteckningen NaCl, en vit kristallin förening som är lättlöslig i vatten. De halvsäkra flaskorna är tillverkade av en specialtillverkad polyolefin. Det är en sampolymer av eten och propylen. Plastens säkerhet har bekräftats genom djurförsök i enlighet med USP:s biologiska standarder för plastbehållare. Behållaren kräver
ingen ångbarriär för att upprätthålla rätt läkemedelskoncentration.
Klinisk farmakologi
Heparin hämmar reaktioner som leder till blodets koagulering och bildandet av fibrinproppar både in vitro och in vivo. Heparin verkar på flera ställen i det normala koagulationssystemet. Små mängder heparin i kombination med antitrombin III (heparinkofaktor) kan hämma trombos genom att inaktivera aktiverad faktor X och hämma omvandlingen av protrombin till trombin. När aktiv trombos har utvecklats kan större mängder heparin hämma ytterligare koagulation genom att inaktivera trombin och förhindra omvandlingen av fibrinogen till fibrin. Heparin förhindrar också bildandet av en stabil fibrinpropp genom att hämma aktiveringen av den fibrinstabiliserande faktorn. Blödningstiden är vanligtvis opåverkad av heparin. Koagulationstiden förlängs av fulla terapeutiska doser heparin; i de flesta fall påverkas den inte mätbart av låga heparindoser. Patienter över 60 år kan efter liknande heparindoser ha högre plasmanivåer av heparin och längre aktiverad partiell tromboplastintid (APTT) jämfört med patienter under 60 år. Högsta plasmanivåer av heparin uppnås 2 till 4 timmar efter subkutan administrering, även om det finns betydande individuella variationer. Loglinjära plottar av heparinplasmakoncentrationer med tiden för ett brett spektrum av dosnivåer är linjära, vilket tyder på att det inte finns några processer av nollordning. Biotransformationen sker i levern och det retikuloendoteliska systemet. Den bifasiska elimineringskurvan, en snabbt avtagande alfafas (t½ =10#) och efter 40 års ålder en långsammare betafas, tyder på upptag i organen. Avsaknaden av ett samband mellan antikoagulerande halveringstid och halveringstidskoncentration kan återspegla faktorer som proteinbindning av heparin. Heparin har ingen fibrinolytisk aktivitet; det kommer därför inte att lysera befintliga blodproppar. Heparin Lock Flush Solution inducerar inte systemisk antikoagulerande verkan vid singeldoser på 10 eller 100 USP-enheter per mL när det används för att bibehålla genomsläppligheten hos intravenösa injektionsanordningar. Den kan störa laboratorietester på blodprover som tas från sådana anordningar, om inte volymen heparin-saltlösning in situ, som är lika stor som kateterns primningsvolym, sugs upp och kasseras innan sådana prover tas. Isotoniska koncentrationer av natriumklorid är lämpliga för parenteral ersättning av kloridförluster som är större än eller lika stora som natriumförlusten. Hypotona koncentrationer av natriumklorid lämpar sig för parenteralt upprätthållande av vattenbehovet när endast små mängder salt önskas.
Natriumklorid i vatten dissocieras för att ge natrium- (Na+) och kloridjoner (Cl-). Natrium (Na+) är den viktigaste katjonen i den
extracellulära vätskan och spelar en stor roll i behandlingen av vätske- och elektrolytstörningar. Klorid (Cl-) har en viktig roll i buffertverkan när syre- och koldioxidutbyte sker i de röda blodkropparna. Distributionen och utsöndringen av natrium (Na+) kontrolleras till stor del av njurarna som upprätthåller balansen mellan intag och utsöndring. Den lilla vätskevolymen och mängden natriumklorid som tillhandahålls av Heparin Lock Flush Solution, USP, när den endast används som ett vehikel för att bibehålla genomsläppligheten av en intravenös injektionsanordning, är osannolikt att utöva en betydande effekt på vätske- och elektrolytbalansen, utom möjligen hos mycket små spädbarn.
Indikationer och användning
Heparin Lock Flush Solution, USP är endast indicerat för att bibehålla genomsläppligheten av en intravenös injektionsanordning. Den kan användas efter den första placeringen av anordningen i venen, efter varje injektion av ett läkemedel eller efter uttag av blod för laboratorieanalys. Lösningen får inte användas för antikoagulationsbehandling.
Kontraindikationer
På grund av bensylalkoholens potentiella toxicitet hos nyfödda får lösningar som innehåller bensylalkohol inte användas i denna patientgrupp. Parenterala preparat med bensylalkohol ska inte användas för vätske- eller natriumkloridersättning. Heparinnatrium ska inte användas hos patienter: Med överkänslighet mot heparin; Med ett okontrollerbart aktivt blödningstillstånd (se Varningar), utom när detta beror på disseminerad intravaskulär koagulation; Med oförmåga att utföra lämpliga blodkoagulationstester, t.ex. koagulationstid i helblod, partiell tromboplastintid etc. med erforderliga intervaller. Det finns vanligtvis inget behov av att övervaka effekten av lågdosheparin hos patienter med normala koagulationsparametrar.
Varningar
Benzylalkohol, ett konserveringsmedel i flaskpreparaten med flerdosflaskor av Heparin Lock Flush Solution, USP, har förknippats med toxicitet hos nyfödda barn. Bensylalkohol har rapporterats vara förknippad med ett fetalt ”Gasping Syndrome” hos för tidigt födda barn. Det finns inga uppgifter om toxiciteten hos andra konserveringsmedel i denna åldersgrupp. Konserveringsmedelsfri Heparin Lock Flush Solution, USP bör användas för att bibehålla genomsläppligheten hos intravenösa injektionsanordningar hos nyfödda. Heparin Lock Flush Solution, USP är inte avsedd för intramuskulär användning, systemisk antikoagulation eller injektion genom någon parenteral administreringsväg.
Överkänslighet: Patienter med dokumenterad överkänslighet mot heparin ska ges läkemedlet endast i klart livshotande situationer.
Blödning: Blödning kan förekomma på praktiskt taget alla ställen hos patienter som får heparin. Ett oförklarligt fall i hematokrit, fall i blodtrycket eller något annat oförklarligt symtom bör leda till att man allvarligt överväger en hemorragisk händelse. Heparinnatrium ska användas med yttersta försiktighet vid sjukdomstillstånd där det finns en ökad risk för blödning. Några av de tillstånd där ökad risk för blödning föreligger är:
Kardiovaskulär- Subakut bakteriell endokardit. Svår hypertoni.
Kirurgisk- Under och omedelbart efter (a) spinalpunktion eller spinalanestesi eller (b) större kirurgi, särskilt när det gäller hjärnan, ryggmärgen eller ögat.
Hematologisk- Tillstånd som är förknippade med ökad blödningsbenägenhet, till exempel hemofili, trombocytopeni och vissa vaskulära purpuror.
Gastrointestinal – Ulcerativa lesioner och kontinuerlig tubdränering av mage eller tunntarm.
Övriga- Menstruation, leversjukdom med försämrad hemostas.
Koagulationstest: Om koagulationstestet är onödigt förlängt eller om blödning inträffar ska heparinnatrium avbrytas omedelbart. Heparinlösningar med en koncentration på 10 USP-heparinenheter/ml kan förändra resultaten av blodkoagulationstester. Heparinkoncentrationer som är högre än 10 USP Heparinenheter/ml kommer att förändra resultaten av blodkoagulationstester.
Tromboocytopeni: Trombocytopeni: Trombocytopeni har rapporterats förekomma hos patienter som får heparin med en rapporterad incidens på 0 till 30 %. Mild trombocytopeni (antal över 100 000/mm3) kan förbli stabil eller vända även om heparin fortsätter. Trombocytopeni av vilken grad som helst bör dock övervakas noga. Om antalet sjunker under 100 000/mm3 eller om återkommande trombos
utvecklas (se Syndrom med vita blodproppar, PRECAUTIONS) ska heparinprodukten sättas ut. Om fortsatt heparinbehandling är nödvändig kan administrering av heparin från en annan organkälla återupptas med försiktighet. Lösningar som innehåller natriumjoner ska användas med stor försiktighet, om alls, hos patienter med kongestiv hjärtsvikt, allvarlig njurinsufficiens och i kliniska tillstånd där det finns ödem med natriumretention.
Försiktighetsåtgärder
Använd inte om lösningen inte är klar och behållaren är oskadad. Använd aseptisk teknik vid enstaka eller flera inmatningar och uttag ur alla behållare. Eftersom heparinnatrium i denna produkt kommer från animalisk vävnad bör den användas med försiktighet hos patienter med allergi i anamnesen.
Interferens med laboratorietester
Heparin interfererar med kompetitiva proteinbindningsmetoder för bestämning av serumtyroxin, vilket resulterar i falskt förhöjda nivåer. Heparin Lock Flush Solution kan störa laboratorieanalyser eller förändra resultaten av blodkemiska tester som glukos, serumnatrium och serumklorid, blodkoagulationsstudier etc. (Se KLINISK FARMACOLOGI.) Följande information som gäller användningen av heparinnatrium som systemiskt antikoagulantium är endast inkluderad som en fråga av intresse eftersom det inte är känt att den gäller för användningen av läkemedlet för heparinlock.
Allmänt:
a. Vitproppssyndrom:
Det har rapporterats att patienter som får heparin kan utveckla ny trombosbildning i samband med trombocytopeni till följd av irreversibel aggregering av trombocyter som induceras av heparin, det så kallade ”vitproppssyndromet”. Processen kan leda till allvarliga tromboemboliska komplikationer som hudnekros, gangrän i extremiteterna som kan leda till amputation, hjärtinfarkt, lungemboli, stroke och eventuellt död. Därför ska heparinadministrationen omedelbart avbrytas om en patient utvecklar ny trombos i samband med trombocytopeni.
b. Heparinresistens:
Ökad resistens mot heparin förekommer ofta vid feber, trombos, tromboflebit, infektioner med trombosbenägenhet, hjärtinfarkt, cancer och hos postoperativa patienter.
c. Ökad risk hos äldre patienter, särskilt kvinnor:
En högre förekomst av blödningar har rapporterats hos patienter, särskilt kvinnor, över 60 år.
Läkemedelsinteraktioner:
Då Heparin Lock Flush Solution, USP endast är avsedd att användas för att bibehålla genomsläppligheten hos intravenösa injektionsanordningar, bör inga tillsatser göras till flerdoseringsflaskor.
Orala antikoagulantia: Heparinnatrium kan förlänga enstegsprotrombintiden. När heparinnatrium ges tillsammans med dikumarol eller warfarinnatrium ska därför en period på minst 5 timmar efter den sista intravenösa dosen förflyta innan blodprov tas om en giltig protrombintid ska erhållas.
Plattinhämmare: Läkemedel som acetylsalicylsyra, dextran, fenylbutazon, ibuprofen, indometacin, dipyridamol, hydroxiklorokin och andra som stör trombocytaggregationsreaktioner (det huvudsakliga hemostatiska försvaret hos hepariniserade patienter) kan framkalla blödning och bör användas med försiktighet hos patienter som får heparinnatrium.
Andra interaktioner: Digitalis, tetracykliner, nikotin, antihistaminer eller I.V. nitroglycerin kan delvis motverka den antikoagulerande effekten av heparinnatrium.
Läkemedels- och laboratorieinteraktioner:
Hyperaminotransferasemi: Betydande förhöjningar av aminotransferasnivåerna (SGOT och SGPT ) har förekommit hos en hög procentandel av patienter (och friska personer) som har fått heparin. Eftersom aminotransferasbestämningar är viktiga vid differentialdiagnostik av hjärtinfarkt, leversjukdom och lungemboli ska höjningar som kan orsakas av läkemedel (som heparin) tolkas med försiktighet.
Carcinogenes, mutagenes, försämrad fertilitet:
Ingen långtidsstudier på djur har utförts för att utvärdera den karcinogena potentialen hos heparin. Inga reproduktionsstudier på djur har heller utförts avseende mutagenes eller försämrad fertilitet.
Graviditet:
Teratogena effekter: Graviditetskategori C. Reproduktionsstudier på djur har inte utförts med heparinnatrium eller natriumklorid. Det är inte heller känt om heparinnatrium eller natriumklorid kan orsaka fosterskador när de administreras till en gravid kvinna eller om de kan påverka reproduktionsförmågan. Heparinnatrium eller natriumklorid ska ges till en gravid kvinna endast om det är uppenbart nödvändigt.
Nonteratogena effekter: Heparin passerar inte placentabarriären.
Sjuksköterskor:
Heparin utsöndras inte i mänsklig mjölk.
Pediatrisk användning:
Säkerhet och effektivitet hos pediatriska patienter har inte fastställts. Får inte användas till nyfödda barn (se VARNINGAR).
Geriatrisk användning:
En högre förekomst av blödningar har rapporterats hos patienter över 60 år, särskilt hos kvinnor (se FÖRSKRIVNINGAR, Allmänt). Kliniska studier tyder på att lägre heparindoser kan vara indicerade för dessa patienter (se KLINISK FARMACOLOGI och DOSERING OCH ADMINISTRATION).
Biverkningar
Och även om biverkningar av intravenös, intramuskulär eller subkutan injektion av 0.9 % bensylalkohol är inte kända hos människa, har experimentella studier av parenterala preparat i liten volym som innehåller 0,9 % bensylalkohol hos flera djurarter indikerat att en uppskattad intravenös dos på upp till 30 ml kan ges säkert till en vuxen utan toxiska effekter. Administrering av en beräknad dos på 9 ml till ett 6 kg tungt spädbarn kan potentiellt ge upphov till blodtrycksförändringar. Heparin Lock Flush Solution är inte känd för att orsaka skadliga lokala eller systemiska effekter av något slag. Även om en avlägsen möjlighet till överkänslighetsreaktion finns vid inträde av extremt små subterapeutiska mängder av lösningen i cirkulationen, har en sådan förekomst inte rapporterats.
Dosering och administrering
Parenterala läkemedelsprodukter ska inspekteras visuellt för partiklar och missfärgning före administrering, när lösning och behållare tillåter det. Lätt missfärgning förändrar inte potensen. (Se FÖRSKRIVNINGAR.) Heparin Lock Flush Solution, USP 10 eller 100 USP-enheter/mL, injiceras som en engångsdos i en intravenös injektionsanordning med hjälp av en lösningsvolym som är likvärdig med volymen i den kvarvarande venpunktionsanordningen. En engångsdos ska injiceras efter venipunktur när den förvaringsbara anordningen inte ska användas omedelbart. Efter varje användning
av den fördjupade venpunktionsanordningen för injektion eller infusion av läkemedel, eller uttag av blodprover, ska ytterligare en dos injiceras för att återställa heparinlåsets effektivitet. Mängden heparinlösning är tillräcklig för att förhindra koagulering i lumen av förvaringsvenipunkter (vanligtvis inte innehållande mer än 0,2 till 0,3 ml) i upp till tjugofyra timmar. När den invärtes anordningen används för att administrera ett läkemedel som är inkompatibelt med heparin ska hela heparinlåset spolas med 0,9 % natriumkloridinjektion, USP före och efter det att läkemedlet administrerats. Efter den andra spolningen ska en ny dos heparinlösning injiceras för att återställa heparinlåsets effektivitet. När den invärtes anordningen används för upprepade uttag av blodprover för laboratorieanalyser och närvaron av heparin eller koksaltlösning sannolikt kommer att störa eller förändra resultaten av de önskade blodproverna, ska heparinspyllösningen in situ rensas från anordningen genom att aspirera och kassera 1 ml innan det önskade blodprovet tas. (See PRECAUTIONS.)
How Supplied
Heparin Lock Flush Solution, USP is supplied in the following dosage forms:
| List No. | Dosage Form | Heparin Sodium (USP Units/mL) |
Solution Volume (mL) |
| 0409-1151-12 | LifeShield Plastic Multple-dose Fliptop vial |
10 | 10 |
| 0409-1151-70 | Plastic Mutliple- dose Fliptop vial |
10 | 10 |
| 0409-1151-78 | Plastic Mutliple- dose Fliptop vial |
10 | 30 |
| 0409-1152-14 | LifeShield Plastic Multple-dose Fliptop vial |
100 | 30 |
| 0409-1152-70 | Plastic Mutliple- dose Fliptop vial |
100 | 10 |
| 0409-1152-78 | Plastic Mutliple- dose Fliptop vial |
100 | 30 |
All of the above may be used with sharp needles. In addition, the LifeShield® products may be used with the LifeShield® Blunt Cannula.
Store at 20° to 25°C (68° to 77°F).
Rev: June 2007
EN-1543
Printed in USA
HOSPIRA, INC., LAKE FOREST, IL 60045 USA
Sample Outer Label

| HEPARIN LOCK FLUSH heparin sodium solution |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – General Injectables & Vaccines, Inc (108250663)
Medical Disclaimer