Generic Name: heparin sodium
Dosage Form: injection, solution
Medically reviewed by Drugs.com. Last updated on February 19, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
WARNING:
NOT FOR USE IN NEONATES
Description
SOLUTION IS INTENDED FOR MAINTENANCE OF PATENCY OF INTRAVENOUS INJECTION DEVICES ONLY AND IS NOT TO BE USED FOR ANTICOAGULANT THERAPY.
Heparin Lock Flush Solution, USP is a sterile, nonpyrogenic, hypertonic preparation of heparin sodium injection, USP with sodium chloride in water for injection.
Each milliliter (mL) contains: Eparina sodica, 10 o 100 unità USP (derivata da mucosa intestinale suina); cloruro di sodio 9 mg; edetato disodico, anidro 0,1 mg aggiunto come stabilizzatore; e alcol benzilico 9 mg aggiunto come conservante in acqua per iniezione. Può contenere idrossido di sodio per la regolazione del pH. pH 6,5 (da 5,0 a 7,5). Le concentrazioni osmolari di queste soluzioni sono 392 mOsmol/L (calc). I prelievi ripetuti possono essere fatti dalla fiala a dosi multiple.
L’eparina Lock Flush Solution, USP è intesa solo per il mantenimento della pervietà dei dispositivi di iniezione endovenosa e non deve essere usata per la terapia anticoagulante.
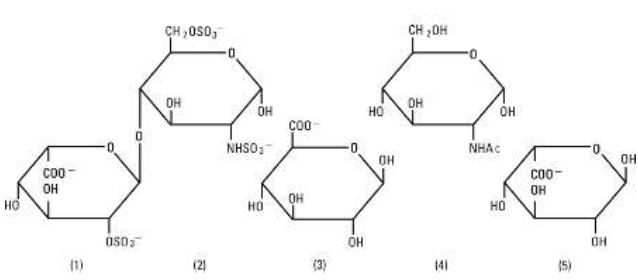
L’eparina sodica, USP è un gruppo eterogeneo di mucopolisaccaridi anionici a catena dritta, chiamati glicosaminoglicani con proprietà anticoagulanti. Anche se altri possono essere presenti, i principali zuccheri presenti nell’eparina sono: (1) a-L-iduronic acid 2-sulfate, (2) 2-deoxy-2-sulfamino-a-D-glucose 6-sulfate, (3) b-D-glucuronic acid, (4) 2-acetamido-2-deoxy-a-D-glucose, e (5) a-L-iduronic acid. Questi zuccheri sono presenti in quantità decrescenti, di solito nell’ordine (2) maggiore di (1) maggiore di (4) maggiore di (3) maggiore di (5), e sono uniti da legami glicosidici, formando polimeri di varie dimensioni. L’eparina è fortemente acida a causa del suo contenuto di gruppi solfato e acido carbossilico legati covalentemente. Nell’eparina sodica i protoni acidi delle unità di solfato sono parzialmente sostituiti da ioni sodio. La potenza è determinata da un test biologico utilizzando uno standard di riferimento USP basato su unità di attività dell’eparina per milligrammo.
Struttura dell’eparina sodica (subunità rappresentative):
Cloruro di sodio, USP è chimicamente designato NaCl, un composto cristallino bianco liberamente solubile in acqua. Le fiale semi-rigide sono fabbricate da una poliolefina appositamente formulata. Si tratta di un copolimero di etilene e propilene. La sicurezza della plastica è stata confermata da test su animali secondo gli standard biologici USP per i contenitori di plastica. Il contenitore non richiede
alcuna barriera di vapore per mantenere la corretta concentrazione del farmaco.
Farmacologia clinica
L’eparina inibisce le reazioni che portano alla coagulazione del sangue e alla formazione di coaguli di fibrina sia in vitro che in vivo. L’eparina agisce in diversi siti del normale sistema di coagulazione. Piccole quantità di eparina in combinazione con l’antitrombina III (cofattore eparinico) possono inibire la trombosi inattivando il fattore X attivato e inibendo la conversione della protrombina in trombina. Una volta che la trombosi attiva si è sviluppata, quantità maggiori di eparina possono inibire l’ulteriore coagulazione inattivando la trombina e impedendo la conversione del fibrinogeno in fibrina. L’eparina impedisce anche la formazione di un coagulo di fibrina stabile inibendo l’attivazione del fattore di stabilizzazione della fibrina. Il tempo di sanguinamento non è solitamente influenzato dall’eparina. Il tempo di coagulazione è prolungato da dosi terapeutiche complete di eparina; nella maggior parte dei casi, non è influenzato in modo misurabile da basse dosi di eparina. I pazienti di età superiore ai 60 anni, a seguito di dosi simili di eparina, possono avere livelli plasmatici di eparina più elevati e tempi di tromboplastina parziale attivata (APTT) più lunghi rispetto ai pazienti di età inferiore ai 60 anni. I livelli plasmatici di picco dell’eparina vengono raggiunti da 2 a 4 ore dopo la somministrazione sottocutanea, sebbene vi siano notevoli variazioni individuali. I grafici loglineari delle concentrazioni plasmatiche di eparina con il tempo per un’ampia gamma di livelli di dose sono lineari, il che suggerisce l’assenza di processi di ordine zero. Il fegato e il sistema reticoloendoteliale sono il sito di biotrasformazione. La curva di eliminazione bifasica, una fase alfa rapidamente decrescente (t½ =10#) e dopo i 40 anni una fase beta più lenta, indica l’assorbimento negli organi. L’assenza di una relazione tra l’emivita dell’anticoagulante e la concentrazione dell’emivita può riflettere fattori quali il legame proteico dell’eparina. L’eparina non ha attività fibrinolitica; pertanto, non lima i coaguli esistenti. Heparin Lock Flush Solution non induce un’azione anticoagulante sistemica a dosi singole di 10 o 100 unità USP per mL quando viene utilizzata per il mantenimento della pervietà dei dispositivi di iniezione endovenosa. Può interferire con i test di laboratorio su campioni di sangue prelevati da tali dispositivi, a meno che il volume di eparina-salina in situ, pari a quello del volume di adescamento del catetere, sia aspirato e scartato prima che tali campioni siano prelevati. Le concentrazioni isotoniche di cloruro di sodio sono adatte alla sostituzione parenterale delle perdite di cloruro che superano o eguagliano la perdita di sodio. Le concentrazioni ipotoniche di cloruro di sodio sono adatte per il mantenimento parenterale del fabbisogno d’acqua quando si desiderano solo piccole quantità di sale.
Il cloruro di sodio in acqua si dissocia per fornire ioni sodio (Na+) e cloruro (Cl-). Il sodio (Na+) è il principale catione del fluido extracellulare e svolge un ruolo importante nella terapia dei disturbi di fluidi ed elettroliti. Il cloruro (Cl-) ha un ruolo integrale nell’azione tampone quando lo scambio di ossigeno e anidride carbonica avviene nei globuli rossi. La distribuzione e l’escrezione del sodio (Na+) sono in gran parte sotto il controllo del rene che mantiene un equilibrio tra l’assunzione e l’uscita. Il piccolo volume di fluido e la quantità di cloruro di sodio forniti da Heparin Lock Flush Solution, USP, quando usato solo come veicolo per mantenere la pervietà di un dispositivo di iniezione endovenosa, è improbabile che eserciti un effetto significativo sul fluido e sull’equilibrio elettrolitico, tranne forse in neonati molto piccoli.
Indicazioni e uso
Heparin Lock Flush Solution, USP è indicato solo per mantenere la pervietà di un dispositivo di iniezione endovenosa. Può essere usata dopo il posizionamento iniziale del dispositivo nella vena, dopo ogni iniezione di un farmaco o dopo il ritiro del sangue per le analisi di laboratorio. La soluzione non deve essere usata per la terapia anticoagulante.
Contraindicazioni
A causa della potenziale tossicità dell’alcol benzilico nei neonati, le soluzioni contenenti alcol benzilico non devono essere usate in questa popolazione di pazienti. Le preparazioni parenterali con alcol benzilico non devono essere usate per la sostituzione di fluidi o cloruro di sodio. L’eparina sodica non deve essere usata nei pazienti: con ipersensibilità all’eparina; con uno stato di sanguinamento attivo incontrollabile (vedere AVVERTENZE), tranne quando questo è dovuto alla coagulazione intravascolare disseminata; con incapacità di eseguire adeguati test di coagulazione del sangue, ad esempio, tempo di coagulazione del sangue intero, tempo di tromboplastina parziale, ecc. agli intervalli richiesti. Di solito non è necessario monitorare l’effetto dell’eparina a basso dosaggio in pazienti con parametri di coagulazione normali.
Avvertenze
L’alcool benzilico, un conservante presente nelle preparazioni in fiale a dosi multiple di Heparin Lock Flush Solution, USP è stato associato a tossicità nei neonati. È stato riportato che l’alcool benzilico è stato associato a una “sindrome del gasping” fetale nei neonati prematuri. Non sono disponibili dati sulla tossicità di altri conservanti in questo gruppo di età. La soluzione senza conservanti Heparin Lock Flush Solution, USP deve essere usata per mantenere la pervietà dei dispositivi di iniezione endovenosa nei neonati. Heparin Lock Flush Solution, USP non è destinato all’uso intramuscolare, all’anticoagulazione sistemica o all’iniezione tramite qualsiasi via parenterale di somministrazione.
Ipersensibilità: Pazienti con documentata ipersensibilità all’eparina dovrebbero ricevere il farmaco solo in situazioni di chiaro pericolo di vita.
Emorragia: L’emorragia può verificarsi praticamente in qualsiasi sito in pazienti che ricevono eparina. Una caduta inspiegabile dell’ematocrito, una caduta della pressione sanguigna o qualsiasi altro sintomo inspiegabile dovrebbe portare a considerare seriamente un evento emorragico. L’eparina sodica deve essere usata con estrema cautela negli stati di malattia in cui c’è un aumentato pericolo di emorragia. Alcune delle condizioni in cui esiste il pericolo aumentato di emorragia sono:
Cardiovascolare- endocardite batterica subacuta. Grave ipertensione.
Chirurgico- Durante e immediatamente dopo (a) spinal tap o anestesia spinale o (b) interventi chirurgici importanti, in particolare che coinvolgono il cervello, il midollo spinale o l’occhio.
ematologico – Condizioni associate a maggiori tendenze di sanguinamento, come l’emofilia, trombocitopenia, e alcune porpora vascolare.
Gastrointestinale – Lesioni ulcerative e drenaggio continuo dello stomaco o dell’intestino tenue.
Altro – Mestruazioni, malattie epatiche con emostasi compromessa.
Test di coagulazione: Se il test di coagulazione è indebitamente prolungato o se si verifica un’emorragia, l’eparina sodica deve essere interrotta immediatamente. Soluzioni di eparina con una concentrazione di 10 USP Heparin Units/mL possono alterare i risultati dei test di coagulazione del sangue. Concentrazioni di eparina maggiori di 10 USP Heparin Units/mL altereranno i risultati dei test di coagulazione del sangue.
Trombocitopenia: Nei pazienti che ricevono eparina è stata riportata trombocitopenia con un’incidenza compresa tra lo 0 e il 30%. Una lieve trombocitopenia (conta superiore a 100.000/mm3) può rimanere stabile o invertire anche se l’eparina viene continuata. Tuttavia, la trombocitopenia di qualsiasi grado deve essere monitorata attentamente. Se la conta scende al di sotto di 100.000/mm3 o se si sviluppa una trombosi ricorrente (vedere Sindrome da coagulo bianco, PRECAUZIONI), il prodotto eparina deve essere interrotto. Se è essenziale continuare la terapia con eparina, la somministrazione di eparina da una fonte organica diversa può essere ripristinata con cautela. Le soluzioni contenenti ioni di sodio devono essere usate con grande cautela, se non del tutto, in pazienti con insufficienza cardiaca congestizia, grave insufficienza renale e in stati clinici in cui esiste un edema con ritenzione di sodio.
Precauzioni
Non usare se la soluzione non è chiara e il contenitore non è danneggiato. Usare la tecnica asettica per l’entrata e l’uscita singola o multipla da tutti i contenitori. Poiché l’eparina sodica contenuta in questo prodotto è derivata da tessuto animale, deve essere usata con cautela nei pazienti con una storia di allergia.
Interferenza con i test di laboratorio
L’eparina interferisce con i metodi di legame proteico competitivo per le determinazioni della tiroxina nel siero, dando luogo a livelli falsamente elevati. Heparin Lock Flush Solution può interferire con le analisi di laboratorio o alterare i risultati dei test ematochimici come glucosio, sodio e cloruro di siero, studi di coagulazione del sangue, ecc. (Le seguenti informazioni che riguardano l’uso di eparina sodica come anticoagulante sistemico sono incluse solo come questione di interesse poiché non sono note per essere applicate all’uso del farmaco per il blocco dell’eparina.
Generale:
a. Sindrome del coagulo bianco:
È stato riportato che i pazienti che assumono eparina possono sviluppare una nuova formazione di trombi in associazione alla trombocitopenia derivante dall’aggregazione irreversibile delle piastrine indotta dall’eparina, la cosiddetta “sindrome del coagulo bianco”. Il processo può portare a gravi complicazioni tromboemboliche come necrosi della pelle, gangrena delle estremità che può portare all’amputazione, infarto miocardico, embolia polmonare, ictus e possibilmente morte. Pertanto, la somministrazione di eparina deve essere prontamente interrotta se un paziente sviluppa una nuova trombosi in associazione con trombocitopenia.
b. Resistenza all’eparina:
L’aumento della resistenza all’eparina si riscontra frequentemente in caso di febbre, trombosi, tromboflebite, infezioni con tendenza alla trombosi, infarto del miocardio, cancro e nei pazienti post-operatori.
c. Aumento del rischio nei pazienti anziani, in particolare nelle donne:
È stata riportata una maggiore incidenza di sanguinamento nei pazienti, in particolare nelle donne, di età superiore ai 60 anni.
Interazioni farmacologiche:
Poiché Heparin Lock Flush Solution, USP è destinato esclusivamente all’uso per mantenere la pervietà dei dispositivi di iniezione endovenosa, non si devono aggiungere additivi alle fiale a dosi multiple.
Onticoagulanti orali: L’eparina sodica può prolungare il tempo di protrombina in una fase. Pertanto, quando l’eparina sodica viene somministrata con dicumarolo o warfarin sodico, deve trascorrere un periodo di almeno 5 ore dopo l’ultima dose endovenosa prima che il sangue venga prelevato se si vuole ottenere un tempo di protrombina valido.
Inibitori piastrinici: Farmaci come l’acido acetilsalicilico, destrano, fenilbutazone, ibuprofene, indometacina, dipiridamolo, idrossiclorochina e altri che interferiscono con le reazioni di aggregazione piastrinica (la principale difesa emostatica dei pazienti eparinizzati) possono indurre sanguinamento e devono essere usati con cautela nei pazienti che ricevono eparina sodica.
Altre interazioni: Digitale, tetracicline, nicotina, antistaminici o nitroglicerina per via endovenosa possono contrastare parzialmente l’azione anticoagulante dell’eparina sodica.
Interazioni farmaco/di laboratorio:
Iperaminotransferasemia: Aumenti significativi dei livelli di aminotransferasi (SGOT e SGPT) si sono verificati in un’alta percentuale di pazienti (e soggetti sani) che hanno ricevuto eparina. Poiché le determinazioni delle aminotransferasi sono importanti nella diagnosi differenziale di infarto miocardico, malattia epatica ed emboli polmonari, gli aumenti che potrebbero essere causati da farmaci (come l’eparina) devono essere interpretati con cautela.
Carcinogenesi, mutagenesi, compromissione della fertilità:
Nessuno studio a lungo termine sugli animali è stato eseguito per valutare il potenziale cancerogeno dell’eparina. Inoltre, non sono stati eseguiti studi sulla riproduzione negli animali riguardanti la mutagenesi o il danneggiamento della fertilità.
Gravidanza:
Effetti teratogeni: Categoria di gravidanza C. Non sono stati condotti studi sulla riproduzione animale con eparina sodica o cloruro di sodio. Non è inoltre noto se l’eparina sodica o il cloruro di sodio possano causare danni al feto se somministrati a una donna incinta o se possano influenzare la capacità riproduttiva. L’eparina sodica o il cloruro di sodio devono essere somministrati a una donna incinta solo se chiaramente necessario.
Effetti non teratogeni: L’eparina non attraversa la barriera placentare.
Madri che allattano:
L’eparina non viene escreta nel latte umano.
Uso pediatrico:
Sicurezza ed efficacia nei pazienti pediatrici non sono state stabilite. Non usare nei neonati (vedi AVVERTENZE).
Uso geriatrico:
Una maggiore incidenza di sanguinamento è stata riportata in pazienti di età superiore ai 60 anni, specialmente nelle donne (vedi PRECAUZIONI, Generale). Studi clinici indicano che in questi pazienti possono essere indicate dosi più basse di eparina (vedi FARMACOLOGIA CLINICA e DOSAGGIO E AMMINISTRAZIONE).
Reazioni avverse
Anche se non sono note reazioni avverse all’iniezione endovenosa intramuscolare o sottocutanea di alcol benzilico allo 0. 9% nell’uomo.9% di alcool benzilico non sono note nell’uomo, studi sperimentali di preparazioni parenterali di piccolo volume contenenti lo 0,9% di alcool benzilico in diverse specie di animali hanno indicato che una dose endovenosa stimata fino a 30 mL può essere somministrata con sicurezza ad un adulto senza effetti tossici. La somministrazione di una dose stimata di 9 mL a un neonato di 6 kg è potenzialmente in grado di produrre variazioni della pressione sanguigna. Non è noto che l’eparina Lock Flush Solution causi effetti avversi locali o sistemici di alcun tipo. Sebbene esista una remota possibilità di reazione di ipersensibilità con l’entrata in circolo di quantità estremamente piccole e subterapeutiche della soluzione, tale evento non è stato riportato.
Dosaggio e somministrazione
I prodotti farmaceutici parenterali devono essere ispezionati visivamente per la presenza di particolato e scolorimento prima della somministrazione, quando la soluzione e il contenitore lo permettono. Una leggera decolorazione non altera l’efficacia. (Eparina Lock Flush Solution, USP 10 o 100 USP Units/mL, viene iniettata come singola dose in un dispositivo di iniezione endovenosa utilizzando un volume di soluzione equivalente a quello del dispositivo di venipuntura indwelling. Una singola dose deve essere iniettata dopo la venipuntura quando il dispositivo indwelling non deve essere usato immediatamente. Dopo ogni utilizzo del dispositivo di venipuntura indwelling per l’iniezione o l’infusione di farmaci, o il prelievo di campioni di sangue, deve essere iniettata un’altra dose per ripristinare l’efficacia del blocco di eparina. La quantità di soluzione di eparina è sufficiente a prevenire la coagulazione all’interno del lume dei dispositivi di venipuntura indwelling (di solito non tiene più di 0,2 a 0,3 mL) fino a ventiquattro ore. Quando il dispositivo indwelling viene utilizzato per somministrare un farmaco incompatibile con l’eparina, l’intero set di blocco dell’eparina deve essere lavato con 0,9% cloruro di sodio per iniezione, USP prima e dopo la somministrazione del farmaco. Dopo il secondo lavaggio, un’altra dose di soluzione di eparina deve essere iniettata per ripristinare l’efficacia del blocco eparinico. Quando il dispositivo indwelling viene utilizzato per il prelievo ripetuto di campioni di sangue per analisi di laboratorio e la presenza di eparina o di soluzione salina potrebbe interferire o alterare i risultati degli esami del sangue desiderati, la soluzione di lavaggio con eparina in situ deve essere eliminata dal dispositivo aspirando e scartando 1 mL prima del prelievo del campione di sangue desiderato. (See PRECAUTIONS.)
How Supplied
Heparin Lock Flush Solution, USP is supplied in the following dosage forms:
| List No. | Dosage Form | Heparin Sodium (USP Units/mL) |
Solution Volume (mL) |
| 0409-1151-12 | LifeShield Plastic Multple-dose Fliptop vial |
10 | 10 |
| 0409-1151-70 | Plastic Mutliple- dose Fliptop vial |
10 | 10 |
| 0409-1151-78 | Plastic Mutliple- dose Fliptop vial |
10 | 30 |
| 0409-1152-14 | LifeShield Plastic Multple-dose Fliptop vial |
100 | 30 |
| 0409-1152-70 | Plastic Mutliple- dose Fliptop vial |
100 | 10 |
| 0409-1152-78 | Plastic Mutliple- dose Fliptop vial |
100 | 30 |
All of the above may be used with sharp needles. In addition, the LifeShield® products may be used with the LifeShield® Blunt Cannula.
Store at 20° to 25°C (68° to 77°F).
Rev: June 2007
EN-1543
Printed in USA
HOSPIRA, INC., LAKE FOREST, IL 60045 USA
Sample Outer Label

| HEPARIN LOCK FLUSH heparin sodium solution |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – General Injectables & Vaccines, Inc (108250663)
Medical Disclaimer