Generic Name: heparin sodium
Dosage Form: injection, solution
Medically reviewed by Drugs.com. Last updated on February 19, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
WARNING:
NOT FOR USE IN NEONATES
Description
SOLUTION IS INTENDED FOR MAINTENANCE OF PATENCY OF INTRAVENOUS INJECTION DEVICES ONLY AND IS NOT TO BE USED FOR ANTICOAGULANT THERAPY.
Heparin Lock Flush Solution, USP is a sterile, nonpyrogenic, hypertonic preparation of heparin sodium injection, USP with sodium chloride in water for injection.
Each milliliter (mL) contains: Heparină sodică, 10 sau 100 unități USP (derivată din mucoasa intestinală porcină); clorură de sodiu 9 mg; edetat disodic, anhidru 0,1 mg adăugat ca stabilizator; și alcool benzilic 9 mg adăugat ca și conservant în apă pentru preparate injectabile. Poate conține hidroxid de sodiu pentru ajustarea pH-ului. pH 6,5 (5,0 până la 7,5). Concentrațiile osmolare ale acestor soluții sunt de 392 mOsmol/L (calc). Se pot face retrageri repetate din flaconul cu doze multiple.
Heparin Lock Flush Solution, USP este destinat numai pentru menținerea permeabilității dispozitivelor de injectare intravenoasă și nu trebuie utilizat pentru terapia anticoagulantă.
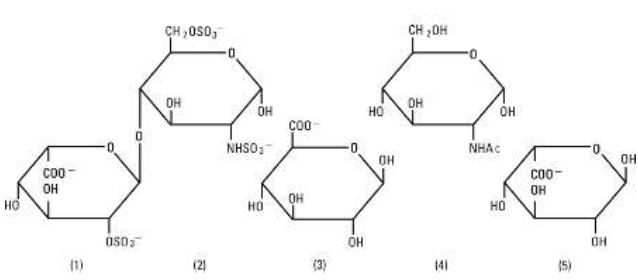
Heparin Sodium, USP este un grup eterogen de mucopolizaharide anionice cu lanț drept, numite glicozaminoglicani cu proprietăți anticoagulante. Deși pot fi prezente și altele, principalele zaharuri care apar în heparină sunt: (1) acidul a-L-iduronic 2-sulfat, (2) 2-deoxi-2-sulfamino-a-D-glucoză 6-sulfat, (3) acidul b-D-glucuronic, (4) 2-acetamido-2-deoxi-a-D-glucoză și (5) acidul a-L-iduronic. Aceste zaharuri sunt prezente în cantități descrescătoare, de obicei în ordinea (2)mai mare decât(1)mai mare decât(4)mai mare decât(3)mai mare decât(5), și sunt unite prin legături glicozidice, formând polimeri de diferite dimensiuni. Heparina este puternic acidă din cauza conținutului său de grupări sulfat și acid carboxilic legate covalent. În heparina sodică, protonii acizi ai unităților de sulfat sunt parțial înlocuiți cu ioni de sodiu. Potența este determinată printr-un test biologic folosind un standard de referință USP bazat pe unități de activitate a heparinei pe miligram.
Structura heparinei sodice (subunități reprezentative):
Clorura de sodiu, USP este denumită chimic NaCl, un compus alb cristalin liber solubil în apă. Flacoanele semi-rigide sunt fabricate dintr-o poliolefină special formulată. Acesta este un copolimer de etilenă și propilenă. Siguranța plasticului a fost confirmată prin teste pe animale în conformitate cu standardele biologice USP pentru recipientele din plastic. Recipientul nu necesită
o barieră de vapori pentru a menține concentrația adecvată a medicamentului.
Farmacologie clinică
Heparina inhibă reacțiile care duc la coagularea sângelui și formarea cheagurilor de fibrină atât in vitro cât și in vivo. Heparina acționează în mai multe locuri din sistemul normal de coagulare. Cantități mici de heparină în combinație cu antitrombina III (cofactor al heparinei) pot inhiba tromboza prin inactivarea factorului X activat și prin inhibarea conversiei protrombinei în trombină. Odată ce s-a dezvoltat o tromboză activă, cantități mai mari de heparină pot inhiba continuarea coagulării prin inactivarea trombinei și prevenirea conversiei fibrinogenului în fibrină. Heparina împiedică, de asemenea, formarea unui cheag stabil de fibrină prin inhibarea activării factorului de stabilizare a fibrinei. Timpul de sângerare nu este de obicei afectat de heparină. Timpul de coagulare este prelungit de dozele terapeutice complete de heparină; în majoritatea cazurilor, acesta nu este afectat în mod măsurabil de doze mici de heparină. Pacienții cu vârsta de peste 60 de ani, în urma administrării unor doze similare de heparină, pot avea niveluri plasmatice mai mari de heparină și timpi de tromboplastină parțială activată (APTT) mai lungi comparativ cu pacienții cu vârsta sub 60 de ani. Nivelurile plasmatice maxime de heparină sunt atinse la 2 până la 4 ore după administrarea subcutanată, deși există variații individuale considerabile. Graficele loglineare ale concentrațiilor plasmatice de heparină în funcție de timp pentru o gamă largă de niveluri de doză sunt liniare, ceea ce sugerează absența proceselor de ordin zero. Ficatul și sistemul reticuloendotelial sunt locul de biotransformare. Curba bifazică de eliminare, o fază alfa care scade rapid (t½ =10#) și după vârsta de 40 de ani o fază beta mai lentă, indică absorbția în organe. Absența unei relații între timpul de înjumătățire anticoagulant și concentrația timpului de înjumătățire poate reflecta factori cum ar fi legarea proteică a heparinei. Heparina nu are activitate fibrinolitică; prin urmare, nu va liza cheagurile existente. Soluția Heparin Lock Flush nu induce o acțiune anticoagulantă sistemică la doze unice de 10 sau 100 unități USP per ml atunci când este utilizată pentru menținerea permeabilității dispozitivelor de injectare intravenoasă. Aceasta poate interfera cu testele de laborator pe probe de sânge prelevate din astfel de dispozitive, cu excepția cazului în care volumul de heparină-salină in situ, egal cu cel al volumului de amorsare a cateterului, este aspirat și aruncat înainte de prelevarea acestor probe. Concentrațiile izotonice de clorură de sodiu sunt adecvate pentru înlocuirea parenterală a pierderilor de clorură care depășesc sau egale cu cele de sodiu. Concentrațiile hipotonice de clorură de sodiu sunt adecvate pentru menținerea parenterală a necesarului de apă atunci când se doresc doar cantități mici de sare.
Clorura de sodiu în apă se disociază pentru a furniza ioni de sodiu (Na+) și de clorură (Cl-). Sodiul (Na+) este principalul cation al fluidului
extracelular și joacă un rol important în terapia tulburărilor de fluide și electrolitice. Clorura (Cl-) are un rol integral în acțiunea de tamponare atunci când are loc schimbul de oxigen și dioxid de carbon în globulele roșii. Distribuția și excreția sodiului (Na+) se află în mare parte sub controlul rinichiului, care menține un echilibru între aport și eliminare. Volumul mic de lichid și cantitatea mică de clorură de sodiu furnizate de Heparin Lock Flush Solution, USP, atunci când este utilizat numai ca vehicul pentru menținerea permeabilității unui dispozitiv de injecție intravenoasă, este puțin probabil să exercite un efect semnificativ asupra echilibrului de lichide și electroliți, cu excepția, eventual, a sugarilor foarte mici.
Indicații și utilizare
Heparin Lock Flush Solution, USP este indicat numai pentru menținerea permeabilității unui dispozitiv de injecție intravenoasă. Poate fi utilizată după plasarea inițială a dispozitivului în venă, după fiecare injectare a unui medicament sau după prelevarea de sânge pentru analize de laborator. Soluția nu trebuie utilizată pentru terapia anticoagulantă.
Contraindicații
Datorită toxicității potențiale a alcoolului benzilic la nou-născuți, soluțiile care conțin alcool benzilic nu trebuie utilizate la această populație de pacienți. Preparatele parenterale cu alcool benzilic nu trebuie utilizate pentru înlocuirea lichidelor sau a clorurii de sodiu. Heparina sodică nu trebuie utilizată la pacienți: Cu hipersensibilitate la heparină; Cu o stare de sângerare activă incontrolabilă (vezi pct. ATENȚIONARE), cu excepția cazului în care aceasta se datorează coagulării intravasculare diseminate; Cu incapacitatea de a efectua teste adecvate de coagulare a sângelui, de exemplu, timpul de coagulare a sângelui integral, timpul parțial de tromboplastină etc. la intervalele necesare. De obicei, nu este necesar să se monitorizeze efectul heparinei în doze mici la pacienții cu parametri normali de coagulare.
Atenționări
Alcoolul benzilic, un conservant din preparatele flacoanelor cu doze multiple de Heparin Lock Flush Solution, USP a fost asociat cu toxicitate la nou-născuți. Alcoolul benzilic a fost raportat ca fiind asociat cu un „sindrom de gâfâit” fetal la nou-născuții prematuri. Nu sunt disponibile date privind toxicitatea altor conservanți la această grupă de vârstă. Soluția de spălare Heparin Lock Flush, USP fără conservanți trebuie utilizată pentru menținerea permeabilității dispozitivelor de injecție intravenoasă la nou-născuți. Heparin Lock Flush Solution, USP nu este destinat utilizării intramusculare, anticoagulării sistemice sau injectării pe orice cale de administrare parenterală.
Hipersensibilitate: Pacienților cu hipersensibilitate documentată la heparină trebuie să li se administreze medicamentul numai în situații care pun în mod clar viața în pericol.
Hemoragie: Hemoragia poate să apară practic la orice loc la pacienții care primesc heparină. O scădere inexplicabilă a hematocritului, o scădere a tensiunii arteriale sau orice alt simptom inexplicabil trebuie să conducă la luarea în considerare serioasă a unui eveniment hemoragic. Heparina sodică trebuie utilizată cu extremă precauție în stările de boală în care există un pericol crescut de hemoragie. Unele dintre stările în care există pericol crescut de hemoragie sunt:
Cardiovasculare- Endocardită bacteriană subacută. Hipertensiune arterială severă.
Chirurgicală- În timpul și imediat după (a) puncție lombară sau anestezie spinală sau (b) intervenții chirurgicale majore, în special cele care implică creierul, măduva spinării sau ochiul.
Hematologică – Afecțiuni asociate cu tendințe crescute de sângerare, cum ar fi hemofilia, trombocitopenia și unele purpuri vasculare.
Gastrointestinale – Leziuni ulcerative și drenaj continuu cu tuburi al stomacului sau intestinului subțire.
Alte- Menstruație, boli hepatice cu afectarea hemostazei.
Testări de coagulare: Dacă testul de coagulare este prelungit în mod nejustificat sau dacă apare hemoragie, heparina sodică trebuie întreruptă imediat. Soluțiile de heparină având o concentrație de 10 unități de heparină USP/mL pot modifica rezultatele testelor de coagulare a sângelui. Concentrațiile de heparină mai mari de 10 unități de heparină USP/mL vor modifica rezultatele testelor de coagulare a sângelui.
Trombocitopenie: S-a raportat apariția trombocitopeniei la pacienții care primesc heparină cu o incidență raportată de 0 până la 30%. Trombocitopenia ușoară (număr mai mare de 100.000/mm3) poate rămâne stabilă sau se poate inversa chiar dacă se continuă administrarea de heparină. Cu toate acestea, trombocitopenia de orice grad trebuie monitorizată îndeaproape. Dacă numărul scade sub 100.000/mm3 sau dacă apare tromboza recurentă
se dezvoltă (vezi Sindromul cheagului alb, PRECAUȚII), produsul cu heparină trebuie întrerupt. În cazul în care continuarea tratamentului cu heparină este esențială, administrarea de heparină de la o sursă de organ diferită poate fi reinstituită cu prudență. Soluțiile care conțin ioni de sodiu trebuie utilizate cu mare atenție, dacă este cazul, la pacienții cu insuficiență cardiacă congestivă, insuficiență renală severă și în stările clinice în care există edeme cu retenție de sodiu.
Precauții
Nu se utilizează decât dacă soluția este limpede și recipientul este intact. Folosiți o tehnică aseptică pentru introducerea și retragerea unică sau multiplă din toate recipientele. Deoarece heparina sodică din acest produs este derivată din țesut animal, trebuie utilizată cu prudență la pacienții cu antecedente de alergie.
Interferența cu testele de laborator
Heparina interferează cu metodele competitive de legare a proteinelor pentru determinarea tiroxinei serice, rezultând niveluri fals crescute. Soluția Heparin Lock Flush poate interfera cu analizele de laborator sau poate modifica rezultatele testelor de chimie a sângelui, cum ar fi glucoza, sodiul seric și clorura serică, studiile de coagulare a sângelui etc. (Vezi FARMACOLOGIE CLINICĂ.) Următoarele informații care se referă la utilizarea heparinei sodice ca anticoagulant sistemic sunt incluse doar ca o chestiune de interes, deoarece nu se știe dacă se aplică la utilizarea medicamentului pentru blocarea heparinei.
Generalități:
a. Sindromul cheagului alb:
A fost raportat faptul că pacienții care iau heparină pot dezvolta formarea de noi trombi în asociere cu trombocitopenia rezultată din agregarea ireversibilă a trombocitelor indusă de heparină, așa-numitul „sindrom al cheagului alb”. Procesul poate duce la complicații tromboembolice severe precum necroza cutanată, gangrena extremităților care poate duce la amputație, infarct miocardic, embolie pulmonară, accident vascular cerebral și, eventual, deces. Prin urmare, administrarea de heparină trebuie întreruptă prompt dacă un pacient dezvoltă o nouă tromboză în asociere cu trombocitopenia.
b. Rezistența la heparină:
Rezistența crescută la heparină este frecvent întâlnită în febră, tromboză, tromboflebită, infecții cu tendințe trombozante, infarct miocardic, cancer și la pacienții postchirurgicali.
c. Risc crescut la pacienții mai în vârstă, în special la femei:
A fost raportată o incidență mai mare a hemoragiilor la pacienții, în special la femei, cu vârsta de peste 60 de ani.
Interacțiuni medicamentoase:
Deoarece Heparin Lock Flush Solution, USP este destinat numai utilizării pentru menținerea permeabilității dispozitivelor de injectare intravenoasă, nu trebuie să se facă adăugiri în flacoanele cu doze multiple.
Anticoagulante orale: Heparina sodică poate prelungi timpul de protrombină într-o singură etapă. Prin urmare, atunci când heparina sodică este administrată împreună cu dicumarol sau warfarină sodică, trebuie să treacă o perioadă de cel puțin 5 ore de la ultima doză intravenoasă înainte de prelevarea sângelui dacă se dorește obținerea unui timp de PROTHROMBIN valabil.
Inhibitori plachetarieni: Medicamente precum acidul acetilsalicilic, dextranul, fenilbutazona, ibuprofenul, indometacinul, dipiridamolul, hidroxiclorochina și altele care interferează cu reacțiile de agregare plachetară (principala apărare hemostatică a pacienților heparinizați) pot induce sângerări și trebuie utilizate cu precauție la pacienții care primesc heparină sodică.
Alte interacțiuni: Digitalicele, tetraciclinele, nicotina, antihistaminicele sau nitroglicerina I.V. pot contracara parțial acțiunea anticoagulantă a heparinei sodice.
Interacțiuni medicamentoase/de laborator:
Hiperaminotransferaemia: Au apărut creșteri semnificative ale nivelurilor aminotransferazelor (SGOT și SGPT ) la un procent ridicat de pacienți (și subiecți sănătoși) care au primit heparină. Deoarece determinările aminotransferazelor sunt importante în diagnosticul diferențial al infarctului miocardic, al afecțiunilor hepatice și al emboliilor pulmonare, creșterile care ar putea fi cauzate de medicamente (cum ar fi heparina) trebuie interpretate cu prudență.
Carcinogeneză, mutageneză, afectarea fertilității:
Nu au fost efectuate studii pe termen lung la animale pentru a evalua potențialul carcinogen al heparinei. De asemenea, nu au fost efectuate studii de reproducere la animale privind mutageneza sau afectarea fertilității.
Femeia:
Efecte teratogene: Sarcina Categoria C. Nu s-au efectuat studii de reproducere pe animale cu heparină sodică sau clorură de sodiu. De asemenea, nu se cunoaște dacă heparina sodică sau clorura de sodiu poate provoca leziuni fetale atunci când este administrată unei femei însărcinate sau poate afecta capacitatea de reproducere. Heparina sodică sau clorura de sodiu trebuie administrată unei femei gravide numai dacă este clar necesar.
Efecte nonteratogene: Heparina nu traversează bariera placentară.
Mamele care alăptează:
Heparina nu este excretată în laptele uman.
Utilizare pediatrică:
Siguranța și eficacitatea la pacienții pediatrici nu au fost stabilite. Nu se utilizează la nou-născuți (vezi pct. ATENȚIONARE).
Utilizare geriatrică:
A fost raportată o incidență mai mare a sângerărilor la pacienții cu vârsta peste 60 de ani, în special la femei (vezi pct.) Studiile clinice indică faptul că doze mai mici de heparină pot fi indicate la acești pacienți (vezi FARMACOLOGIE CLINICĂ și DOZE ȘI ADMINISTRARE).
Reacții adverse
Deși reacțiile adverse la injectarea intravenoasă intramusculară sau subcutanată de 0.9% alcool benzilic nu sunt cunoscute la om, studiile experimentale ale preparatelor parenterale de volum mic care conțin 0,9% alcool benzilic la mai multe specii de animale au indicat faptul că o doză intravenoasă estimată de până la 30 ml poate fi administrată în siguranță unui adult fără efecte toxice. Administrarea unei doze estimate de 9 ml la un sugar de 6 kg este potențial capabilă să producă modificări ale tensiunii arteriale. Nu se cunoaște ca Heparin Lock Flush Solution să provoace efecte adverse locale sau sistemice de orice fel. Deși există o posibilitate îndepărtată de reacție de hipersensibilitate în cazul pătrunderii în circulație a unor cantități subterapeutice extrem de mici de soluție, o astfel de apariție nu a fost raportată.
Dosare și administrare
Produsele medicamentoase parenterale trebuie inspectate vizual pentru detectarea particulelor și a decolorării înainte de administrare, ori de câte ori soluția și recipientul permit acest lucru. O ușoară decolorare nu modifică potența. (Vezi pct. PRECAUȚII.) Heparin Lock Flush Solution, USP 10 sau 100 unități USP/mL, se injectează ca doză unică într-un dispozitiv de injectare intravenoasă, utilizând un volum de soluție echivalent cu cel al dispozitivului de puncție venoasă cu permanență. O singură doză trebuie injectată după puncția venoasă atunci când dispozitivul cu inserție permanentă nu urmează să fie utilizat imediat. După fiecare utilizare
a dispozitivului de puncție venoasă indwelling pentru injectarea sau perfuzia de medicamente, sau pentru prelevarea de probe de sânge, trebuie injectată o altă doză pentru a restabili eficacitatea blocării heparinei. Cantitatea de soluție de heparină este suficientă pentru a preveni coagularea în interiorul lumenului dispozitivelor de puncție venoasă permanente (de obicei nu reține mai mult de 0,2 până la 0,3 ml) timp de până la douăzeci și patru de ore. Atunci când dispozitivul permanent este utilizat pentru a administra un medicament care este incompatibil cu heparina, întregul set de blocare cu heparină trebuie spălat cu clorură de sodiu injectabilă 0,9%, USP, înainte și după administrarea medicamentului. După a doua spălare, trebuie injectată o altă doză de soluție de heparină pentru a restabili eficacitatea dispozitivului de blocare cu heparină. Atunci când dispozitivul permanent este utilizat pentru prelevarea repetată de probe de sânge pentru analize de laborator, iar prezența heparinei sau a soluției saline este susceptibilă să interfereze cu sau să modifice rezultatele testelor de sânge dorite, soluția de spălare cu heparină in situ trebuie eliminată din dispozitiv prin aspirarea și aruncarea a 1 ml înainte de prelevarea probei de sânge dorite. (See PRECAUTIONS.)
How Supplied
Heparin Lock Flush Solution, USP is supplied in the following dosage forms:
| List No. | Dosage Form | Heparin Sodium (USP Units/mL) |
Solution Volume (mL) |
| 0409-1151-12 | LifeShield Plastic Multple-dose Fliptop vial |
10 | 10 |
| 0409-1151-70 | Plastic Mutliple- dose Fliptop vial |
10 | 10 |
| 0409-1151-78 | Plastic Mutliple- dose Fliptop vial |
10 | 30 |
| 0409-1152-14 | LifeShield Plastic Multple-dose Fliptop vial |
100 | 30 |
| 0409-1152-70 | Plastic Mutliple- dose Fliptop vial |
100 | 10 |
| 0409-1152-78 | Plastic Mutliple- dose Fliptop vial |
100 | 30 |
All of the above may be used with sharp needles. In addition, the LifeShield® products may be used with the LifeShield® Blunt Cannula.
Store at 20° to 25°C (68° to 77°F).
Rev: June 2007
EN-1543
Printed in USA
HOSPIRA, INC., LAKE FOREST, IL 60045 USA
Sample Outer Label

| HEPARIN LOCK FLUSH heparin sodium solution |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – General Injectables & Vaccines, Inc (108250663)
Medical Disclaimer