Generic Name: heparin sodium
Dosage Form: injection, solution
Medically reviewed by Drugs.com. Last updated on February 19, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
WARNING:
NOT FOR USE IN NEONATES
Description
SOLUTION IS INTENDED FOR MAINTENANCE OF PATENCY OF INTRAVENOUS INJECTION DEVICES ONLY AND IS NOT TO BE USED FOR ANTICOAGULANT THERAPY.
Heparin Lock Flush Solution, USP is a sterile, nonpyrogenic, hypertonic preparation of heparin sodium injection, USP with sodium chloride in water for injection.
Each milliliter (mL) contains: Heparin-nátrium, 10 vagy 100 USP egység (sertés bélnyálkahártyából származik); nátrium-klorid 9 mg; stabilizátorként hozzáadott vízmentes 0,1 mg dinátrium-edetát; és tartósítószerként hozzáadott 9 mg benzil-alkohol injekcióhoz való vízben. A pH beállításához nátrium-hidroxidot tartalmazhat. pH 6,5 (5,0-7,5). Ezen oldatok ozmoláris koncentrációja 392 mOsmol/L (calc). A többszörös adagolású injekciós üvegből többszöri vétel is végezhető.
A Heparin Lock Flush Solution, USP kizárólag intravénás injekciós eszközök átjárhatóságának fenntartására szolgál, és nem használható véralvadásgátló terápiára.
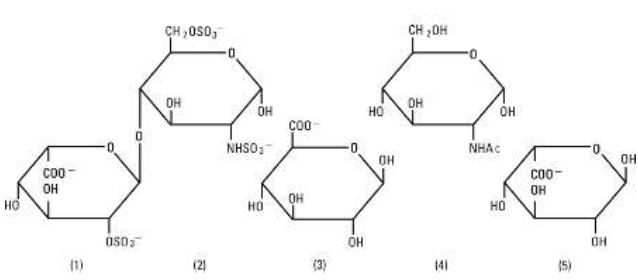
A Heparin Sodium, USP egy heterogén csoportja az egyenes láncú anionos mukopoliszacharidoknak, az úgynevezett glikozaminoglikánoknak, amelyek véralvadásgátló tulajdonságokkal rendelkeznek. Bár előfordulhatnak mások is, a heparinban előforduló fő cukrok a következők: (1) a-L-iduronsav-2-szulfát, (2) 2-deoxi-2-szulfamino-a-D-glükóz-6-szulfát, (3) b-D-glükuronsav, (4) 2-acetamido-2-deoxi-a-D-glükóz és (5) a-L-iduronsav. Ezek a cukrok csökkenő mennyiségben vannak jelen, általában a (2)nagyobb mint(1)nagyobb mint(4)nagyobb mint(3)nagyobb mint(5) sorrendben, és glikozidos kötésekkel kapcsolódnak egymáshoz, különböző méretű polimereket alkotva. A heparin erősen savas, mivel kovalensen kapcsolt szulfát- és karbonsavcsoportokat tartalmaz. A heparin-nátriumban a szulfátegységek savas protonjait részben nátriumionok helyettesítik. A hatásosságot biológiai vizsgálattal határozzák meg egy USP referenciastandard segítségével, amely a heparin aktivitásának milligrammonkénti egységein alapul.
A heparin-nátrium szerkezete (reprezentatív alegységek):
A nátrium-klorid, USP kémiai jelölése NaCl, fehér kristályos, vízben szabadon oldódó vegyület. A félmerev injekciós üvegek speciálisan kialakított poliolefinből készülnek. Ez etilén és propilén kopolimerje. A műanyag biztonságosságát a műanyag tartályokra vonatkozó USP biológiai szabványoknak megfelelő állatkísérletek igazolták. A tartály nem igényel
gőzgátat a megfelelő gyógyszerkoncentráció fenntartásához.
Klinikai farmakológia
A heparin mind in vitro, mind in vivo gátolja a véralvadáshoz és a fibrinrögök kialakulásához vezető reakciókat. A heparin a normál véralvadási rendszerben több helyen is hat. Kis mennyiségű heparin antitrombin III-mal (heparin kofaktor) kombinálva gátolhatja a trombózist az aktivált X faktor inaktiválásával és a protrombin trombinná történő átalakulásának gátlásával. Ha már kialakult az aktív trombózis, nagyobb mennyiségű heparin gátolhatja a további véralvadást a trombin inaktiválásával és a fibrinogén fibrinné történő átalakulásának megakadályozásával. A heparin a fibrinstabilizáló faktor aktiválódásának gátlásával megakadályozza a stabil fibrinrög kialakulását is. A vérzési időt a heparin általában nem befolyásolja. A véralvadási időt a heparin teljes terápiás dózisai meghosszabbítják; a legtöbb esetben a heparin alacsony dózisai nem befolyásolják mérhetően. A 60 év feletti betegeknél hasonló heparinadagokat követően a 60 év alatti betegekhez képest magasabb lehet a heparin plazmaszintje és hosszabb az aktivált parciális tromboplasztin idő (APTT). A heparin csúcs plazmaszintje a szubkután beadást követően 2-4 órával érhető el, bár jelentős egyéni eltérések vannak. A heparin plazmakoncentrációjának loglineáris ábrái az idő függvényében a dózisszintek széles tartományában lineárisak, ami nulladik rendű folyamatok hiányára utal. A biotranszformáció helyszíne a máj és a retikuloendothelialis rendszer. A kétfázisú eliminációs görbe, egy gyorsan csökkenő alfa fázis (t½ =10#) és 40 éves kor után egy lassabb béta fázis, a szervi felvételre utal. Az antikoaguláns felezési ideje és a felezési idő koncentrációja közötti kapcsolat hiánya olyan tényezőket tükrözhet, mint például a heparin fehérjekötődése. A heparinnak nincs fibrinolitikus aktivitása; ezért nem oldja fel a meglévő vérrögöket. A Heparin Lock Flush oldat nem vált ki szisztémás véralvadásgátló hatást 10 vagy 100 USP egység/ml egyszeri adagban, ha intravénás injekciós eszközök átjárhatóságának fenntartására alkalmazzák. Zavarhatja az ilyen eszközökből levett vérminták laboratóriumi vizsgálatát, kivéve, ha a katéter alapozó térfogatával megegyező mennyiségű in situ heparin-sóoldatot a mintavétel előtt leszívják és eldobják. A nátrium-klorid izotóniás koncentrációi alkalmasak a nátriumveszteséget meghaladó vagy azzal megegyező kloridveszteség parenterális pótlására. A nátrium-klorid hipotóniás koncentrációi alkalmasak a vízszükséglet parenterális fenntartására, amikor csak kis mennyiségű sóra van szükség.
A nátrium-klorid a vízben nátrium (Na+) és klorid (Cl-) ionokká disszociál. A nátrium (Na+) a
extracelluláris folyadék fő kationja, és nagy szerepet játszik a folyadék- és elektrolit zavarok terápiájában. A klorid (Cl-) a pufferhatásban játszik szerves szerepet, amikor a vörösvértestekben oxigén- és széndioxidcsere történik. A nátrium (Na+) elosztása és kiválasztása nagyrészt a vese ellenőrzése alatt áll, amely fenntartja az egyensúlyt a bevitel és a kiválasztás között. A Heparin Lock Flush Solution, USP által biztosított kis mennyiségű folyadék és nátrium-klorid mennyisége, amennyiben csak az intravénás injekciós eszköz átjárhatóságának fenntartására szolgál, nem valószínű, hogy jelentős hatást gyakorolna a folyadék- és elektrolitegyensúlyra, kivéve esetleg nagyon kis csecsemőknél.
Indikációk és alkalmazás
A Heparin Lock Flush Solution, USP csak az intravénás injekciós eszköz átjárhatóságának fenntartására javallott. Használható az eszköz vénába történő első behelyezését követően, a gyógyszer minden egyes injekciózása után vagy a vér laboratóriumi elemzésre történő levétele után. Az oldat nem használható véralvadásgátló terápiához.
Ellenejavallatok
A benzil-alkohol újszülötteknél jelentkező potenciális toxicitása miatt a benzil-alkoholt tartalmazó oldatok nem használhatók ebben a betegpopulációban. A benzil-alkoholt tartalmazó parenterális készítmények nem használhatók folyadék- vagy nátrium-kloridpótlásra. Heparin-nátrium nem alkalmazható a betegeknél: Heparinnal szembeni túlérzékenységben szenvedőknél; Ellenőrizhetetlen aktív vérzéses állapotban (lásd VIGYÁZATI FIGYELMEZTETÉS), kivéve, ha ez disszeminált intravaszkuláris véralvadás következménye; Alkalmatlanok a megfelelő véralvadási vizsgálatok, pl. teljes véralvadási idő, parciális tromboplasztin idő stb. előírt időközönként történő elvégzésére. Normális véralvadási paraméterekkel rendelkező betegeknél általában nincs szükség a kis dózisú heparin hatásának ellenőrzésére.”
Figyelmeztetések
A Heparin Lock Flush Solution, USP többadagos injekciós üvegkészítményeiben lévő benzil-alkoholt, mint tartósítószert újszülötteknél toxicitással hozták összefüggésbe. A benzil-alkoholt koraszülött csecsemőknél magzati “ziháló szindrómával” hozták összefüggésbe. Más tartósítószerek toxicitásáról ebben a korcsoportban nem állnak rendelkezésre adatok. A tartósítószermentes Heparin Lock Flush Solution, USP-t újszülötteknél az intravénás injekciós eszközök átjárhatóságának fenntartására kell használni. A Heparin Lock Flush Solution, USP nem alkalmas intramuszkuláris alkalmazásra, szisztémás antikoagulációra vagy bármely parenterális beadási útvonalon történő beadásra.
Túlérzékenység: A heparinnal szembeni dokumentált túlérzékenységben szenvedő betegeknek csak egyértelműen életveszélyes helyzetekben szabad a gyógyszert adni.
Vérzés: A heparint kapó betegeknél gyakorlatilag bármely helyen vérzés léphet fel. A hematokrit megmagyarázhatatlan csökkenése, vérnyomásesés vagy bármely más megmagyarázhatatlan tünet esetén komolyan fontolóra kell venni a vérzéses eseményt. A heparin-nátriumot rendkívüli óvatossággal kell alkalmazni olyan betegségállapotokban, amelyekben fokozott a vérzésveszély. Néhány olyan állapot, amelyben fokozott vérzésveszély áll fenn:
Kardiovaszkuláris- Szubakut bakteriális endokarditis. Súlyos magas vérnyomás.
Sebészeti- (a) gerinccsapolás vagy gerincvelői érzéstelenítés vagy (b) nagyobb műtét során és közvetlenül azt követően, különösen az agyat, a gerincvelőt vagy a szemet érintően.
Hematológiai – Fokozott vérzési hajlammal járó állapotok, mint például hemofília, trombocitopénia és egyes vaszkuláris purpurák.
Gasztrointesztinális – Fekélyes elváltozások és a gyomor vagy a vékonybél folyamatos csőürítése.
Egyéb – Menstruáció, májbetegség, amely károsodott vérzéscsillapítással jár.
Véralvadási vizsgálatok: Ha a véralvadási vizsgálat indokolatlanul elhúzódik, vagy ha vérzés lép fel, a heparin-nátriumot azonnal abba kell hagyni. A 10 USP Heparin egység/ml koncentrációjú heparin oldatok megváltoztathatják a véralvadási vizsgálatok eredményeit. A 10 USP Heparin egység/ml-nél nagyobb heparinkoncentráció megváltoztatja a véralvadási vizsgálatok eredményeit.
Thrombocitopénia: Trombocitopénia előfordulását jelentették heparint kapó betegeknél, a jelentett előfordulási gyakoriság 0-30%. Az enyhe trombocitopénia (100 000/mm3-nél nagyobb szám) a heparin szedésének folytatása esetén is stabil maradhat vagy visszafordulhat. Bármilyen mértékű trombocitopéniát azonban szorosan figyelemmel kell kísérni. Ha a szám 100 000/mm3 alá csökken, vagy ha ismétlődő trombózis
jelenik meg (lásd Fehérvérrög-szindróma, ÓVALÓSÍTÁSOK), a heparinkészítményt abba kell hagyni. Ha a heparinterápia folytatása elengedhetetlen, a heparin más szervi forrásból történő beadása óvatosan visszaállítható. A nátriumionokat tartalmazó oldatokat nagy óvatossággal kell alkalmazni, ha egyáltalán alkalmazni kell, pangásos szívelégtelenségben, súlyos veseelégtelenségben szenvedő betegeknél és olyan klinikai állapotokban, amelyekben nátriumretencióval járó ödéma áll fenn.
Figyelmeztetések
Nem szabad használni, ha az oldat nem tiszta és a tartály nem sérült. Használjon aszeptikus technikát az egyszeri vagy többszöri bevitelhez és az összes tartályból történő kivonáshoz. Mivel a termékben lévő heparin-nátrium állati szövetből származik, óvatosan kell alkalmazni olyan betegeknél, akiknél a kórtörténetben allergia szerepel.
Interferencia a laboratóriumi vizsgálatokkal
A heparin interferál a szérum tiroxin meghatározására szolgáló kompetitív fehérjekötő módszerekkel, ami tévesen emelkedett szinteket eredményez. A Heparin Lock Flush oldat zavarhatja a laboratóriumi elemzéseket vagy megváltoztathatja a vérkémiai vizsgálatok, mint például a glükóz, szérum nátrium és szérum klorid, véralvadási vizsgálatok stb. eredményeit. (Lásd KLINIKAI FARMAKOLÓGIA.) Az alábbi, a heparin-nátrium szisztémás véralvadásgátlóként történő alkalmazására vonatkozó információkat csak érdekességként közöljük, mivel nem ismert, hogy azok a gyógyszer heparin zárásra történő alkalmazására vonatkoznak.
Általános:
a. Fehér vérrög szindróma:
Beszámoltak arról, hogy a heparint szedő betegeknél a heparin által kiváltott trombocitopéniával összefüggésben a vérlemezkék irreverzibilis aggregációja következtében új trombusképződés alakulhat ki, az úgynevezett “fehér vérrög szindróma”. A folyamat súlyos tromboembóliás szövődményekhez vezethet, mint például bőrelhalás, a végtagok gangrénája, amely amputációhoz, szívinfarktushoz, tüdőembóliához, stroke-hoz és esetleg halálhoz vezethet. Ezért a heparin adagolását azonnal abba kell hagyni, ha a betegnél trombocitopénia mellett új trombózis alakul ki.
b. Heparinrezisztencia:
A heparinnal szembeni fokozott rezisztencia gyakran fordul elő láz, trombózis, tromboflebitisz, trombózisra hajlamos fertőzések, szívinfarktus, rák és műtét utáni betegek esetében.
c. Fokozott kockázat idősebb betegeknél, különösen nőknél:
60 év feletti betegeknél, különösen nőknél, a vérzés nagyobb gyakoriságáról számoltak be.
Kölcsönhatások:
Mivel a Heparin Lock Flush Solution, USP kizárólag intravénás injekciós eszközök átjárhatóságának fenntartására szolgál, a több adagot tartalmazó fiolákhoz nem szabad adalékanyagokat adni.
Orális antikoagulánsok: A heparinnátrium meghosszabbíthatja az egylépcsős protrombinidőt. Ezért ha a heparin-nátriumot dikumarollal vagy warfarin-nátriummal együtt adják, az utolsó intravénás adag után legalább 5 órának el kell telnie a vérvétel előtt, ha érvényes PROTHROMBIN-időt akarnak kapni.
Plateletgátlók: Az olyan gyógyszerek, mint az acetilszalicilsav, dextrán, fenilbutazon, ibuprofén, indometacin, dipiridamol, hidroxiklorokvin és mások, amelyek zavarják a vérlemezke-aggregációs reakciókat (a heparinizált betegek fő hemosztatikus védekező mechanizmusát), vérzést okozhatnak, ezért heparin-nátriumot kapó betegeknél óvatosan kell alkalmazni.
Más kölcsönhatások: A digitalis, a tetraciklinek, a nikotin, az antihisztaminok vagy az intravénás nitroglicerin részben ellensúlyozhatják a heparin-nátrium véralvadásgátló hatását.
Készítmények/laboratóriumi kölcsönhatások:
Hyperaminotranszferázia: Az aminotranszferáz (SGOT és SGPT ) szintek jelentős emelkedése fordult elő azon betegek (és egészséges személyek) nagy százalékánál, akik heparint kaptak. Mivel az aminotranszferáz meghatározások fontosak a szívinfarktus, a májbetegség és a tüdőembólia differenciáldiagnosztikájában, a gyógyszerek (mint a heparin) által esetlegesen okozott emelkedéseket óvatosan kell értelmezni.
Karcinogenezis, mutagenezis, a termékenység károsodása:
A heparin karcinogén potenciáljának értékelésére nem végeztek állatokon végzett hosszú távú vizsgálatokat. Szintén nem végeztek állatokon reprodukciós vizsgálatokat a mutagenezisre vagy a termékenység károsodására vonatkozóan.
Vemhesség:
Teratogén hatások: Terhességi kategória C. Állati reprodukciós vizsgálatokat nem végeztek heparin-nátriummal vagy nátrium-kloriddal. Az sem ismert, hogy a heparin-nátrium vagy a nátrium-klorid okozhat-e magzati károsodást, ha terhes nőnek adják, vagy befolyásolhatja-e a reprodukciós képességet. Heparin-nátriumot vagy nátrium-kloridot csak akkor szabad terhes nőnek adni, ha egyértelműen szükséges.
Nonteratogén hatások: A heparin nem lépi át a placentáris gátat.
Szoptató anyák:
A heparin nem választódik ki az emberi tejbe.
GYermekgyógyászati alkalmazás:
A biztonságosság és hatékonyság gyermekbetegeknél nem bizonyított. Újszülötteknél nem alkalmazható (lásd: FIGYELMEZTETÉS).
Geriátriai alkalmazás:
60 év feletti betegeknél, különösen nőknél, a vérzés nagyobb gyakoriságáról számoltak be (lásd: ÁLTALÁNOS ÓVALLATOK, általános). Klinikai vizsgálatok azt mutatják, hogy ezeknél a betegeknél alacsonyabb heparinadagok alkalmazása javallott lehet (lásd KLINIKAI FARMAKOLÓGIA és ADAGOLÁS ÉS ADAGOLÁS).
Mellékhatások
Noha az intravénás intramuszkuláris vagy szubkután 0.9%-os benzil-alkoholnak emberben nem ismertek, a 0,9%-os benzil-alkoholt tartalmazó kis térfogatú parenterális készítményekkel végzett kísérletes vizsgálatok több állatfajon azt mutatták, hogy egy felnőttnek becsült 30 ml-ig terjedő intravénás dózis biztonságosan beadható toxikus hatások nélkül. Becslések szerint 9 mL beadása 6 kg-os csecsemőnek potenciálisan képes vérnyomásváltozást előidézni. A Heparin Lock Flush oldatról nem ismert, hogy bármilyen helyi vagy szisztémás káros hatást okozna. Bár a túlérzékenységi reakció távoli lehetősége fennáll az oldat rendkívül kis szubterápiás mennyiségének a keringésbe kerülésével, ilyen esetről nem számoltak be.
Adagolás és alkalmazás
A beadás előtt, amennyiben az oldat és a tartály lehetővé teszi, a parenterális gyógyszerkészítményeket szemrevételezéssel meg kell vizsgálni részecskék és elszíneződések szempontjából. Az enyhe elszíneződés nem változtatja meg a hatásosságot. (Lásd az ELŐKÉSZÍTÉSEK-et.) A Heparin Lock Flush oldat, USP 10 vagy 100 USP egység/ml, egyszeri adagként intravénás injekciós eszközbe kell beadni, a bennfekvő vénapunkciós eszközzel megegyező mennyiségű oldatot használva. Egyszeri adagot kell beadni a vénapunkciót követően, ha a bentlakásos eszközt nem kell azonnal használni. A vénapunkciós eszköz minden egyes használata után
gyógyszer befecskendezéséhez vagy infúziójához, illetve vérvételhez egy újabb adagot kell beadni a heparinzár hatékonyságának helyreállítása érdekében. A heparinoldat mennyisége elegendő ahhoz, hogy huszonnégy órán keresztül megakadályozza a vérrögképződést a bentlakásos vénapunkciós eszköz lumenében (általában nem tart több mint 0,2-0,3 ml-t). Ha a bentlakásos eszközt olyan gyógyszer beadására használják, amely nem kompatibilis a heparinnal, a teljes heparinzár készletet 0,9%-os nátrium-klorid injekcióval (USP) kell átöblíteni a gyógyszer beadása előtt és után. A második öblítést követően egy újabb adag heparinoldatot kell beadni a heparinzár hatékonyságának helyreállítása érdekében. Ha a bentlakásos eszközt laboratóriumi elemzésekhez szükséges vérminták ismételt levételére használják, és a heparin vagy sóoldat jelenléte valószínűleg zavarja vagy megváltoztatja a kívánt vérvizsgálatok eredményeit, az in situ heparin öblítőoldatot a kívánt vérmintavétel előtt 1 ml leszívásával és eldobásával ki kell üríteni az eszközből. (See PRECAUTIONS.)
How Supplied
Heparin Lock Flush Solution, USP is supplied in the following dosage forms:
| List No. | Dosage Form | Heparin Sodium (USP Units/mL) |
Solution Volume (mL) |
| 0409-1151-12 | LifeShield Plastic Multple-dose Fliptop vial |
10 | 10 |
| 0409-1151-70 | Plastic Mutliple- dose Fliptop vial |
10 | 10 |
| 0409-1151-78 | Plastic Mutliple- dose Fliptop vial |
10 | 30 |
| 0409-1152-14 | LifeShield Plastic Multple-dose Fliptop vial |
100 | 30 |
| 0409-1152-70 | Plastic Mutliple- dose Fliptop vial |
100 | 10 |
| 0409-1152-78 | Plastic Mutliple- dose Fliptop vial |
100 | 30 |
All of the above may be used with sharp needles. In addition, the LifeShield® products may be used with the LifeShield® Blunt Cannula.
Store at 20° to 25°C (68° to 77°F).
Rev: June 2007
EN-1543
Printed in USA
HOSPIRA, INC., LAKE FOREST, IL 60045 USA
Sample Outer Label

| HEPARIN LOCK FLUSH heparin sodium solution |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – General Injectables & Vaccines, Inc (108250663)
Medical Disclaimer