Generic Name: heparin sodium
Dosage Form: injection, solution
Medically reviewed by Drugs.com. Last updated on February 19, 2021.
- Overview
- Side Effects
- Dosage
- Professional
- Tips
- Interactions
- More
WARNING:
NOT FOR USE IN NEONATES
Description
SOLUTION IS INTENDED FOR MAINTENANCE OF PATENCY OF INTRAVENOUS INJECTION DEVICES ONLY AND IS NOT TO BE USED FOR ANTICOAGULANT THERAPY.
Heparin Lock Flush Solution, USP is a sterile, nonpyrogenic, hypertonic preparation of heparin sodium injection, USP with sodium chloride in water for injection.
Each milliliter (mL) contains: Heparina sódica, 10 ó 100 unidades USP (derivada de la mucosa intestinal porcina); cloruro sódico 9 mg; edetato disódico, anhidro 0,1 mg añadido como estabilizador; y alcohol bencílico 9 mg añadido como conservante en agua para inyección. Puede contener hidróxido de sodio para ajustar el pH. pH 6,5 (5,0 a 7,5). Las concentraciones osmolares de estas soluciones son de 392 mOsmol/L (calc). Pueden realizarse extracciones repetidas del vial de dosis múltiples.
La solución de bloqueo de heparina, USP está destinada al mantenimiento de la permeabilidad de los dispositivos de inyección intravenosa únicamente y no debe utilizarse para el tratamiento anticoagulante.
La heparina sódica, USP es un grupo heterogéneo de mucopolisacáridos aniónicos de cadena recta, denominados glicosaminoglicanos que tienen propiedades anticoagulantes. Aunque pueden estar presentes otros, los principales azúcares presentes en la heparina son (1) ácido a-L-idurónico 2-sulfato, (2) 2-deoxi-2-sulfamino-a-D-glucosa 6-sulfato, (3) ácido b-D-glucurónico, (4) 2-acetamido-2-deoxi-a-D-glucosa, y (5) ácido a-L-idurónico. Estos azúcares están presentes en cantidades decrecientes, normalmente en el orden (2)mayor que(1)mayor que(4)mayor que(3)mayor que(5), y están unidos por enlaces glucosídicos, formando polímeros de diferentes tamaños. La heparina es fuertemente ácida debido a su contenido de grupos de sulfato y ácido carboxílico unidos covalentemente. En la heparina sódica, los protones ácidos de las unidades de sulfato se sustituyen parcialmente por iones de sodio. La potencia se determina mediante un ensayo biológico utilizando un estándar de referencia USP basado en unidades de actividad de heparina por miligramo.
Estructura de la heparina sódica (subunidades representativas):
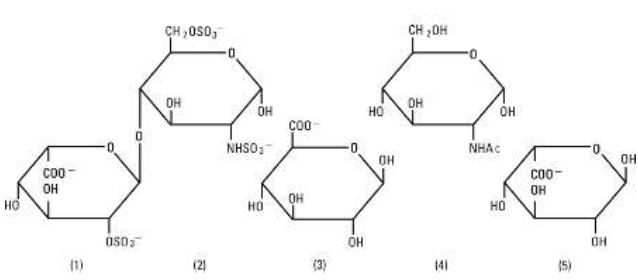
El cloruro de sodio, USP se designa químicamente como NaCl, un compuesto blanco cristalino libremente soluble en agua. Los viales semirrígidos están fabricados con una poliolefina especialmente formulada. Se trata de un copolímero de etileno y propileno. La seguridad del plástico ha sido confirmada por ensayos en animales según las normas biológicas de la USP para envases de plástico. El envase no requiere
barrera de vapor para mantener la concentración adecuada del medicamento.
Farmacología clínica
La heparina inhibe las reacciones que conducen a la coagulación de la sangre y a la formación de coágulos de fibrina tanto in vitro como in vivo. La heparina actúa en múltiples sitios del sistema normal de coagulación. Pequeñas cantidades de heparina en combinación con la antitrombina III (cofactor de la heparina) pueden inhibir la trombosis al inactivar el Factor X activado e inhibir la conversión de protrombina en trombina. Una vez que se ha desarrollado la trombosis activa, cantidades mayores de heparina pueden inhibir la coagulación adicional inactivando la trombina e impidiendo la conversión del fibrinógeno en fibrina. La heparina también impide la formación de un coágulo de fibrina estable al inhibir la activación del factor estabilizador de la fibrina. El tiempo de sangrado no suele verse afectado por la heparina. El tiempo de coagulación se prolonga con dosis terapéuticas completas de heparina; en la mayoría de los casos, no se ve afectado de forma apreciable por dosis bajas de heparina. Los pacientes mayores de 60 años, tras dosis similares de heparina, pueden tener niveles plasmáticos más altos de heparina y tiempos parciales de tromboplastina activados (APTT) más largos en comparación con los pacientes menores de 60 años. Los niveles plasmáticos máximos de heparina se alcanzan entre 2 y 4 horas después de la administración subcutánea, aunque existen considerables variaciones individuales. Los gráficos logarítmicos de las concentraciones plasmáticas de heparina con el tiempo para una amplia gama de niveles de dosis son lineales, lo que sugiere la ausencia de procesos de orden cero. El hígado y el sistema reticuloendotelial son los lugares de biotransformación. La curva de eliminación bifásica, una fase alfa que disminuye rápidamente (t½ =10#) y después de los 40 años una fase beta más lenta, indica la captación en los órganos. La ausencia de una relación entre la vida media del anticoagulante y la concentración de la vida media puede reflejar factores como la unión a proteínas de la heparina. La heparina no tiene actividad fibrinolítica; por lo tanto, no lisará los coágulos existentes. Heparin Lock Flush Solution no induce una acción anticoagulante sistémica a dosis únicas de 10 o 100 unidades USP por mL cuando se utiliza para el mantenimiento de la permeabilidad de los dispositivos de inyección intravenosa. Puede interferir con los análisis de laboratorio de las muestras de sangre extraídas de dichos dispositivos, a menos que el volumen de heparina-salina in situ, igual al del volumen de cebado del catéter, sea aspirado y desechado antes de tomar dichas muestras. Las concentraciones isotónicas de cloruro de sodio son adecuadas para la reposición parenteral de las pérdidas de cloruro que superan o igualan la pérdida de sodio. Las concentraciones hipotónicas de cloruro de sodio son adecuadas para el mantenimiento parenteral de las necesidades de agua cuando sólo se desean pequeñas cantidades de sal.
El cloruro de sodio en el agua se disocia para proporcionar iones de sodio (Na+) y cloruro (Cl-). El sodio (Na+) es el principal catión del líquido extracelular y desempeña un papel importante en la terapia de las alteraciones de líquidos y electrolitos. El cloruro (Cl-) desempeña un papel integral en la acción amortiguadora cuando se produce el intercambio de oxígeno y dióxido de carbono en los glóbulos rojos. La distribución y la excreción de sodio (Na+) están en gran medida bajo el control del riñón, que mantiene el equilibrio entre la ingesta y la salida. El pequeño volumen de líquido y la cantidad de cloruro de sodio proporcionados por Heparin Lock Flush Solution, USP, cuando se utiliza únicamente como vehículo para mantener la permeabilidad de un dispositivo de inyección intravenosa, es poco probable que ejerza un efecto significativo sobre el equilibrio de líquidos y electrolitos, excepto posiblemente en bebés muy pequeños.
Indicciones y uso
Heparin Lock Flush Solution, USP está indicado únicamente para mantener la permeabilidad de un dispositivo de inyección intravenosa. Puede utilizarse después de la colocación inicial del dispositivo en la vena, después de cada inyección de un medicamento o después de la extracción de sangre para análisis de laboratorio. La solución no debe utilizarse para el tratamiento anticoagulante.
Contraindicaciones
Debido a la potencial toxicidad del alcohol bencílico en neonatos, las soluciones que contienen alcohol bencílico no deben utilizarse en esta población de pacientes. Las preparaciones parenterales con alcohol bencílico no deben utilizarse para la reposición de líquidos o cloruro sódico. La heparina sódica no debe utilizarse en pacientes Con hipersensibilidad a la heparina; Con un estado de hemorragia activa incontrolable (ver ADVERTENCIAS), excepto cuando se deba a una coagulación intravascular diseminada; Con incapacidad para realizar pruebas de coagulación sanguínea adecuadas, por ejemplo, tiempo de coagulación de la sangre total, tiempo de tromboplastina parcial, etc. a los intervalos requeridos. Por lo general, no es necesario monitorizar el efecto de la heparina a dosis bajas en pacientes con parámetros de coagulación normales.
Advertencias
El alcohol bencílico, un conservante en las preparaciones de viales de dosis múltiples de Heparina Lock Flush Solution, USP se ha asociado con toxicidad en neonatos. Se ha informado de que el alcohol bencílico está asociado a un «síndrome de jadeo» fetal en bebés prematuros. No se dispone de datos sobre la toxicidad de otros conservantes en este grupo de edad. La solución de bloqueo de heparina sin conservantes, USP, debe utilizarse para mantener la permeabilidad de los dispositivos de inyección intravenosa en neonatos. Heparin Lock Flush Solution, USP no está destinado al uso intramuscular, a la anticoagulación sistémica o a la inyección por cualquier vía de administración parenteral.
Hipersensibilidad: Los pacientes con hipersensibilidad documentada a la heparina deben recibir el medicamento sólo en situaciones de clara amenaza para la vida.
Hemorragia: Puede producirse una hemorragia en prácticamente cualquier lugar en los pacientes que reciben heparina. Una caída inexplicable del hematocrito, una caída de la presión arterial o cualquier otro síntoma inexplicable debe llevar a considerar seriamente un evento hemorrágico. La heparina sódica debe utilizarse con extrema precaución en los estados de enfermedad en los que existe un mayor peligro de hemorragia. Algunas de las condiciones en las que existe un mayor peligro de hemorragia son:
Cardiovascular- Endocarditis bacteriana subaguda. Hipertensión grave.
Quirúrgico- Durante e inmediatamente después de (a) una punción lumbar o anestesia espinal o (b) una intervención quirúrgica importante, especialmente que afecte al cerebro, la médula espinal o el ojo.
Hematológico- Afecciones asociadas con una mayor tendencia a las hemorragias, como la hemofilia, la trombocitopenia y algunas púrpuras vasculares.
Gastrointestinal – Lesiones ulcerosas y drenaje por tubo continuo del estómago o del intestino delgado.
Otros – Menstruación, enfermedad hepática con alteración de la hemostasia.
Prueba de coagulación: Si la prueba de coagulación se prolonga indebidamente o si se produce una hemorragia, la heparina sódica debe suspenderse rápidamente. Las soluciones de heparina con una concentración de 10 unidades de heparina USP/mL pueden alterar los resultados de las pruebas de coagulación sanguínea. Las concentraciones de heparina superiores a 10 Unidades de Heparina USP/mL alterarán los resultados de las pruebas de coagulación sanguínea.
Trombocitopenia: Se ha notificado la aparición de trombocitopenia en pacientes que reciben heparina con una incidencia notificada del 0 al 30%. La trombocitopenia leve (recuento superior a 100.000/mm3) puede permanecer estable o revertir incluso si se continúa con la heparina. Sin embargo, la trombocitopenia de cualquier grado debe vigilarse estrechamente. Si el recuento cae por debajo de 100.000/mm3 o si se desarrolla una trombosis recurrente (ver Síndrome del coágulo blanco, PRECAUCIONES), debe suspenderse el producto de heparina. Si el tratamiento continuado con heparina es esencial, la administración de heparina de una fuente orgánica diferente puede reinstaurarse con precaución. Las soluciones que contienen iones de sodio deben utilizarse con gran cuidado, si es que se utilizan, en pacientes con insuficiencia cardíaca congestiva, insuficiencia renal grave y en estados clínicos en los que exista edema con retención de sodio.
Precauciones
No utilizar a menos que la solución sea transparente y el envase esté intacto. Utilizar una técnica aséptica para la entrada y retirada única o múltiple de todos los envases. Dado que la heparina sódica de este producto procede de tejido animal, debe utilizarse con precaución en pacientes con antecedentes de alergia.
Interferencia con las pruebas de laboratorio
La heparina interfiere con los métodos competitivos de unión a proteínas para las determinaciones de tiroxina en suero, dando lugar a niveles falsamente elevados. Heparin Lock Flush Solution puede interferir con los análisis de laboratorio o alterar los resultados de las pruebas de química sanguínea como la glucosa, el sodio y el cloruro séricos, los estudios de coagulación sanguínea, etc. (Véase FARMACOLOGÍA CLÍNICA.) La siguiente información que se refiere al uso de la heparina sódica como anticoagulante sistémico se incluye sólo como cuestión de interés, ya que no se sabe si es aplicable al uso del medicamento para el bloqueo de la heparina.
Generalidades:
a. Síndrome del coágulo blanco:
Se ha comunicado que los pacientes que reciben heparina pueden desarrollar la formación de nuevos trombos en asociación con la trombocitopenia resultante de la agregación irreversible de las plaquetas inducida por la heparina, el llamado «síndrome del coágulo blanco». Este proceso puede dar lugar a complicaciones tromboembólicas graves, como necrosis cutánea, gangrena de las extremidades que puede conducir a la amputación, infarto de miocardio, embolia pulmonar, accidente cerebrovascular y, posiblemente, la muerte. Por lo tanto, la administración de heparina debe interrumpirse rápidamente si un paciente desarrolla una nueva trombosis en asociación con la trombocitopenia.
b. Resistencia a la heparina:
El aumento de la resistencia a la heparina se encuentra frecuentemente en la fiebre, la trombosis, la tromboflebitis, las infecciones con tendencia a la trombosis, el infarto de miocardio, el cáncer y en los pacientes posquirúrgicos.
c. Riesgo aumentado en pacientes de edad avanzada, especialmente mujeres:
Se ha notificado una mayor incidencia de hemorragias en pacientes, especialmente mujeres, mayores de 60 años.
Interacciones con otros medicamentos:
Como Heparina Lock Flush Solution, USP está destinada únicamente a mantener la permeabilidad de los dispositivos de inyección intravenosa, no se deben añadir aditivos a los viales de dosis múltiples.
Anticoagulantes orales: La heparina sódica puede prolongar el tiempo de protrombina de una etapa. Por lo tanto, cuando se administra heparina sódica con dicumarol o warfarina sódica, debe transcurrir un período de al menos 5 horas después de la última dosis intravenosa antes de la extracción de sangre si se quiere obtener un tiempo de protrombina válido.
Inhibidores plaquetarios: Medicamentos como el ácido acetilsalicílico, el dextrano, la fenilbutazona, el ibuprofeno, la indometacina, el dipiridamol, la hidroxicloroquina y otros que interfieren con las reacciones de agregación plaquetaria (la principal defensa hemostática de los pacientes heparinizados) pueden inducir hemorragias y deben utilizarse con precaución en pacientes que reciben heparina sódica.
Otras interacciones: Los digitálicos, las tetraciclinas, la nicotina, los antihistamínicos o la nitroglicerina intravenosa pueden contrarrestar parcialmente la acción anticoagulante de la heparina sódica.
Interacciones medicamentosas/laborales:
Hiperaminotransferemia: Se han producido elevaciones significativas de los niveles de aminotransferasas (SGOT y SGPT ) en un alto porcentaje de pacientes (y sujetos sanos) que han recibido heparina. Dado que las determinaciones de aminotransferasa son importantes en el diagnóstico diferencial del infarto de miocardio, la enfermedad hepática y las embolias pulmonares, las elevaciones que puedan ser causadas por medicamentos (como la heparina) deben interpretarse con precaución.
Carcinogénesis, mutagénesis, deterioro de la fertilidad:
No se han realizado estudios a largo plazo en animales para evaluar el potencial carcinogénico de la heparina. Tampoco se han realizado estudios de reproducción en animales en relación con la mutagénesis o el deterioro de la fertilidad.
Embarazo:
Efectos teratogénicos: Embarazo Categoría C. No se han realizado estudios de reproducción en animales con heparina sódica o cloruro sódico. Tampoco se sabe si la heparina sódica o el cloruro sódico pueden causar daño fetal cuando se administran a una mujer embarazada o pueden afectar a la capacidad de reproducción. La heparina sódica o el cloruro sódico deben administrarse a una mujer embarazada sólo si es claramente necesario.
Efectos no teratogénicos: La heparina no atraviesa la barrera placentaria.
Madres lactantes:
La heparina no se excreta en la leche humana.
Uso pediátrico:
No se ha establecido la seguridad y eficacia en pacientes pediátricos. No debe usarse en neonatos (ver ADVERTENCIAS).
Uso geriátrico:
Se ha notificado una mayor incidencia de hemorragias en pacientes mayores de 60 años, especialmente en mujeres (ver PRECAUCIONES, Generales). Los estudios clínicos indican que pueden estar indicadas dosis más bajas de heparina en estos pacientes (ver FARMACOLOGÍA CLÍNICA y DOSIFICACIÓN Y ADMINISTRACIÓN).
Reacciones adversas
Aunque las reacciones adversas a la inyección intravenosa intramuscular o subcutánea de alcohol bencílico al 0.9% de alcohol bencílico no se conocen en el hombre, los estudios experimentales de preparaciones parenterales de pequeño volumen que contienen alcohol bencílico al 0,9% en varias especies de animales han indicado que una dosis intravenosa estimada de hasta 30 mL puede administrarse con seguridad a un adulto sin efectos tóxicos. La administración de una dosis estimada de 9 mL a un bebé de 6 kg es potencialmente capaz de producir cambios en la presión sanguínea. No se conoce que la solución de bloqueo de heparina cause efectos adversos locales o sistémicos de ningún tipo. Aunque existe una remota posibilidad de reacción de hipersensibilidad con la entrada de cantidades subterapéuticas extremadamente pequeñas de la solución en la circulación, no se ha notificado tal ocurrencia.
Dosificación y administración
Los productos farmacéuticos parenterales deben inspeccionarse visualmente en busca de partículas y decoloración antes de su administración, siempre que la solución y el envase lo permitan. Una ligera decoloración no altera la potencia. (Ver PRECAUCIONES.) La solución de bloqueo de heparina, USP 10 o 100 unidades USP/mL, se inyecta como una dosis única en un dispositivo de inyección intravenosa utilizando un volumen de solución equivalente al del dispositivo de venopunción permanente. Debe inyectarse una dosis única después de la venopunción cuando el dispositivo permanente no vaya a utilizarse inmediatamente. Después de cada uso
del dispositivo de venipunción permanente para la inyección o infusión de medicamentos, o la extracción de muestras de sangre, debe inyectarse otra dosis para restaurar la eficacia del bloqueo de heparina. La cantidad de solución de heparina es suficiente para evitar la coagulación dentro del lumen de los dispositivos de venopunción permanentes (normalmente no se mantiene más de 0,2 a 0,3 mL) durante un máximo de veinticuatro horas. Cuando el dispositivo permanente se utiliza para administrar un fármaco que es incompatible con la heparina, todo el conjunto de bloqueo de heparina debe lavarse con cloruro de sodio al 0,9%, USP, antes y después de la administración del medicamento. Tras el segundo lavado, debe inyectarse otra dosis de solución de heparina para restablecer la eficacia del bloqueo de heparina. Cuando el dispositivo permanente se utiliza para la extracción repetida de muestras de sangre para análisis de laboratorio y es probable que la presencia de heparina o solución salina interfiera o altere los resultados de los análisis de sangre deseados, la solución de lavado de heparina in situ debe eliminarse del dispositivo aspirando y desechando 1 mL antes de extraer la muestra de sangre deseada. (See PRECAUTIONS.)
How Supplied
Heparin Lock Flush Solution, USP is supplied in the following dosage forms:
| List No. | Dosage Form | Heparin Sodium (USP Units/mL) |
Solution Volume (mL) |
| 0409-1151-12 | LifeShield Plastic Multple-dose Fliptop vial |
10 | 10 |
| 0409-1151-70 | Plastic Mutliple- dose Fliptop vial |
10 | 10 |
| 0409-1151-78 | Plastic Mutliple- dose Fliptop vial |
10 | 30 |
| 0409-1152-14 | LifeShield Plastic Multple-dose Fliptop vial |
100 | 30 |
| 0409-1152-70 | Plastic Mutliple- dose Fliptop vial |
100 | 10 |
| 0409-1152-78 | Plastic Mutliple- dose Fliptop vial |
100 | 30 |
All of the above may be used with sharp needles. In addition, the LifeShield® products may be used with the LifeShield® Blunt Cannula.
Store at 20° to 25°C (68° to 77°F).
Rev: June 2007
EN-1543
Printed in USA
HOSPIRA, INC., LAKE FOREST, IL 60045 USA
Sample Outer Label

| HEPARIN LOCK FLUSH heparin sodium solution |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – General Injectables & Vaccines, Inc (108250663)
Medical Disclaimer